|
Veterinaria Trop. 09: 3-15 1984 CULTIVO DE CÉLULAS
BHK21 CLON 13 EN SUSPENSIÓN: J. Obregón*, P. Ramos*, J. Aponte* y N. Conde* * FONAIAP. Centro
Nacional de Investigaciones Veterinarias |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
RESUMEN En el Laboratorio de Cultivo de Tejidos Celulares del Instituto de Investigaciones Veterinarias (CENIAP-FONAIAP), se utiliza la línea celular BHK 21 clon 13, adaptada a cultivos en suspensión para la multiplicación del virus de la fiebre aftosa, la cual se utiliza como antígeno en la producción de vacuna antiaftosa inactivada. Con el propósito de aumentar la producción celular, se construyó un fermentador sencillo experimental de 12 litros, con aireación al cultivo, lo cual permite el máximo aprovechamiento del volumen de cultivo disponible y la optimización del desarrollo de la población celular. Partiendo de una densidad celular inicial promedio de 7 x 105 cel/ml (D.S.: ± 0,20 x 105) se alcanza una densidad celular final de 1,81 x 106 cel/ml (D.S.: ± 0,79 x 105), en un lapso de tiempo de 22,9 horas (D.S.: ± 2,5), lo que significa un índice de multiplicación de 2,5 (D.S.:± 0,67) y una producción total de 1,05 x 1010 células por cultivo. En este trabajo se describe la técnica empleada para aumentar la producción celular. INTRODUCCIÓN El creciente interés dedicado a los campos de investigación viral y producción de vacuna, ha traído como consecuencia la necesidad de incrementar la producción del cultivo masivo de células eucarióticas. En muchos laboratorios se utiliza la línea celular BHK 21 clon 13, adaptada a cultivos en suspensión para la replicación del virus de la fiebre aftosa (2,6), la cual se aprovecha como antígeno para la producción de vacuna. En el Laboratorio de Cultivo de Tejidos Celulares, del Instituto de Investigaciones Veterinarias (CENIAP-FONAIAP) se utiliza un método de cultivo mixto (monocapa-suspensión-monocapa), tripsinizando monocapas adaptadas para desarrollar cultivos en suspensión y finalmente sembrarlos en frascos rotatorios para obtener monocapas susceptibles al virus de la fiebre aftosa (7). En la etapa de cultivo en suspensión convencional se usan botellas Pyrex de 8 litros, aprovechando sólo el 30% (2,5 litros aproximadamente) de su volumen, debido a que la población celular utiliza para su respiración únicamente el aire presente en el envase. Se podría considerar el vaso de cultivo como un sistema de diálisis en el cual un nutrimento (oxígeno) se difunde a través de la interfase gas-líquido y se disuelve en el cultivo. Existe una relación entre la máxima tasa de crecimiento y la máxima tasa de solución de oxígeno en el cultivo, éste incrementará su población hasta el punto en que el sistema suministre oxígeno a su máxima capacidad; desde este momento, el incremento celular tenderá a ser lineal (1) y el oxígeno se habrá convertido en el nutrimento limitante. Al respecto, Deschaux et al. (4) estudiaron el metabolismo respiratorio de las células BHK Clon 13, señalando que su actividad respiratoria es más intensa, precoz y durable que en cultivos en monocapa. Con el propósito de obviar esta limitante, se realizaron varias experiencias aireando cultivos de BHK 21 Clon 13 en suspensión, que condujeron al diseño de un aparato fermentador cuya construcción y técnica de operación se describen en el presente trabajo. MATERIALES Y MÉTODOS Materiales Frasco aspirador
Schott de 15 litros 4203/NS 60 Reactivos Solución salina
fosfatada (PBS) Medio Minimum Essential
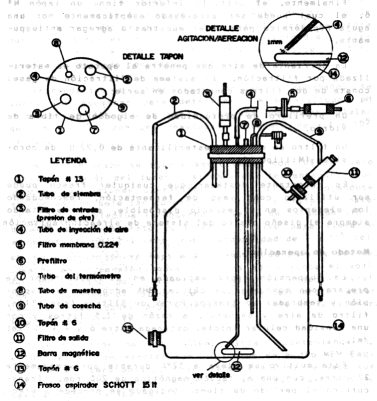
Medium (Eagle) GIBCO Cat. N° 4101100 CONSTRUCCIÓN DEL APARATO FERMENTADOR El vaso fermentador consiste en un frasco Schott de 15 litros, el cual posee tres aberturas, dos superiores y una inferior, en las cuales se acomodan los tapones que portan los elementos del aparato. La Figura 1 muestra la disposición general de los componentes. El tapón superior N° 13 está atravesado por los siguientes elementos:
Los tubos de metal y de vidrio fueron sellados al tapón N° 13 con cemento de resinas epóxicas marca DURO. Esta resina sintética soporta el proceso de esterilización por autoclave. La otra abertura superior está obturada por un tapón N° 6 que sostiene un filtro de aire, el cual usa como elemento filtrante algodón de fibra de vidrio, éste permite el escape de gases al exterior del aparato. Finalmente, el orificio inferior tiene un tapón N° 6, el cual puede ser atravesado asépticamente por una aguja hipodérmica para tomar muestras o agregar antiespumante. La corriente de aire que penetra al aparato es esterilizada por filtración. El sistema de filtración de gases consta de dos filtros conectados en serie:
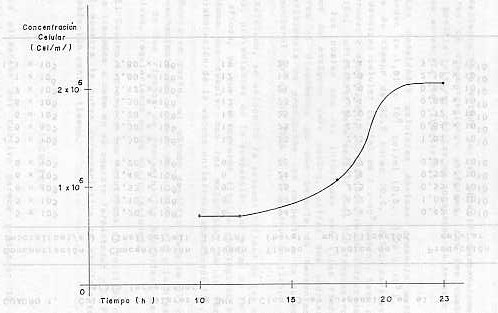
Es importante destacar que cualquier frasco puede ser utilizado como vaso de fermentación, reacomodando los elementos en el espacio disponible, pero respetando siempre el diseño básico del sistema de aireación/agitación. Método de operación La suspensión madre empleada en el fermentador se prepara con monocapas de células BHK adaptadas a suspensión y sembradas en frascos Pyrex de 8 litros (con sifón, filtro de aire y magneto), a razón de 2,5 litros y con una densidad celular inicial estimada entre 6 y 7 x 105 cel /ml. Este cultivo se lleva a 37°C durante aproximadamente 22 horas, con una agitación magnética de 200 r.p.m.. Transcurrido el periodo de tiempo indicado se procede a efectuar el contaje celular correspondiente, calculándose que el cultivo debe haber alcanzado una concentración celular que permita la siembra del fermentador, con un volumen oscilante entre 5-6 litros y densidad celular entre 5-7 x 105 cel/ml. Una vez cargado el aparato de fermentación con la suspensión madre, se lleva a estufa a 37°C y se conecta la bomba de aire al ducto de entrada del sistema de filtración de gases, ajustando la corriente de aire a un flujo aproximado de dos burbujas/segundo, con la pinza destinada a tal efecto. Se calibra la velocidad de agitación magnética a 300 r.p.m., dejándose el cultivo a 37°C durante un período comprendido entre 22-24 horas. Transcurrido el tiempo de incubación señalado, se toman las muestras para determinar la esterilidad, pH y concentración celular (se estima una población celular de 1,6 x 106 con una desviación standard de ± 4 x 105 cel/ml. A continuación se agrega medio Eagle con 10% de suero bovino a través del tubo de siembra del fermentador, llevándolo a un volumen operacional de 12 litros, dejándose en incubación bajo las condiciones antes descritas. Posteriormente se efectúa la cosecha de parte de la suspensión, dejando en el aparato suficiente cultivo para llevarlo a un volumen de 12 litros, con una densidad de 7 x 105 cel/ml. Esta operación se repite diariamente durante la semana, cosechando suspensión todos los días manteniendo el volumen de cultivo del fermentador hasta su cosecha final. Una vez obtenido el volumen de suspensión celular, de acuerdo con las necesidades existentes, se procede a la siembra de los frascos roller. Siete litros de suspensión celular, conteniendo 1,2 x 106 cel/ml, se mezclan con 10 litros de medio MEM Eagle con 10% de suero bovino, repartiéndose 400 ml de esta suspensión a cada frasco roller, por lo cual cada uno fue sembrado con 2 x 108 células. Una vez sembrados, los frascos roller se llevan a estufa a 37°C, con rotación de 0,5 r.p.m. durante 72 horas, período de tiempo en el cual se completan las monocapas, procediéndose a inocularlas con el virus para obtener su multiplicación. RESULTADOS Mediante este método se han obtenido suspensiones celulares de concentraciones uniformes, con las cuales ha sido posible cultivar células en monocapas en frascos rotatorios en escala semi-industrial. Las densidades celulares máximas promedio están en el orden de 1,81 x 106 cel/ml (D.S. 0,79 x 105), en un lapso de tiempo de 22,9 horas (D.S. 2,5), partiendo de una densidad celular inicial de 7 x 105 cel/ml. Esto permite producir semanalmente aproximadamente 30 litros de suspensión, suficientes para sembrar unos 300 frascos rotatorios los cuales una vez infectados con virus rinden 80 litros de antígeno para vacuna, cifras que podrían ser mayores al disponerse de una bacteria de fermentadores. La eficiencia de producción con respecto a la suspensión convencional es de un 150% y el ahorro de tiempo es de 10%. Asimismo, se evidenció la susceptibilidad de las monocapas, provenientes de la suspensión, al virus de la fiebre aftosa, ya que se lograron títulos serológicos e infeccioso que cumplen con las exigencias de la técnica de elaboración de la vacuna antiaftosa inactivada (3). Por otra parte, el método descrito permite el total aprovechamiento del volumen de cultivo útil y la disminución de los riesgos de contaminación bacteriana de los cultivos, requiriendo menos manipulaciones. El Cuadro 1 presenta los resultados de cultivos celulares llevados a cabo en el aparato fermentador y la Figura 2 muestra la curva característica de crecimiento de la población contra tiempo.
DISCUSIÓN La aireación del cultivo parece prolongar la fase logarítmica de crecimiento y posponer la fase estacionaria, debido a que elimina el problema de la depresión de la concentración de oxígeno disuelto y, probablemente, permite la oxidación de los ácidos orgánicos de desecho y la elevación del pH. En los experimentos no se intentó el control del pH; sin embargo, éste se mantuvo en un promedio de 7,2 (D.S. 0,16). Fontages et al. (5) demuestran que el control de pH no es necesario en fermentadores pequeños, pero es imperativo en fermentadores de mayor capacidad. El fermentador aquí descrito tiene la ventaja de la simplicidad y sencillez de construcción, operación y mantenimiento; puede ser útil en experimentos pilotos para propósitos de propagación masiva de líneas celulares animales en suspensión, producción de semilla para fermentadores industriales y entrenamiento de personal en esta técnica de producción; asimismo, se podría adaptar al cultivo de diversas cepas bacterianas. En todo caso, en cultivos de organismos patógenos deberán tomarse precauciones estrictas y tratar los gases de escape del aparato antes de permitir su salida a la atmósfera. SUMMARY The Laboratory of Celular Tissue Culture at Instituto de Investigaciones Veterinarias (FONAIAP-CENIAP) uses the continuos cell line BHK 21 clon 13 adapted to grow in suspension for the multiplication of the foot-and-mouth disease virus, which is used as antigen for the production of an inactivated vaccine. With the purpose of increasing the celular production it was built a simple, 12 liter capacity, experimental fermenter with aeration to the culture which optimized the use of the volumen available and improves the conditions for the development of the celular population. Starting with a average initial density of 7 x 105 cel/ml (S.D.± 0,20 x 105), a final celular density of 1,81 x 106 cel/ml (S.D.: ± 0,79 x 105) was reached within 22,9 hours (S.D. ± 2,5) which means a multiplication rate of 2,5 (S.D.: ± 0,67) and a total production of 1,05 x 1010 cells per culture. The details for the construction of the fermenter and the techniques to operate it are described. AGRADECIMIENTO Se agradece al Dr. Jesús Castañeda el apoyo y estimulo; al Lic. Juan Ernesto Ludert, por la revisión y discusión del presente trabajo; al Centro Panamericano de Fiebre Aftosa, institución que impartió la formación técnica, y a la Sra. Irma Puerta de Fuentes, por su trabajo secretarial. BIBLIOGRAFÍA 1. BAUER, S. y J. SHILOACH. Maximal exponential growth rate and yield of E. coli obtainable in a benchscale fermentator. Biotechnol. Bioeng. 16:933. 1974. 2. CAPSTICK, P.B., R.C. TELLING, W.G. CHAPMAN y D.L. STEWART. Growth of a cloned strain of hamster kidney cells in suspended culture and their susceptibility to the virus of food-and-mouth disease. Nature 195: 1163, 1962. 3. CENTRO PANAMFRICANO DE FIEBRE AFTOSA. Manual de procedimientos para el control de vacuna antiaftosa. Rió de Janeiro, 1980 48p. (Serie de Manuales Técnicos N° 2) 4. DESCHAUX, P., C. JOPPIN y R. FONTAGES. Etude comparative des métabolismes protéiques et des systémes enzymatiques respiratoires entre des cellules BHK 21 cultivées en suspension et en couche monocellulaire. C.R. Soc.Biol. 164:2269. 1970. 5. FONTAGES, R., P. DESCHAUX e Y. BEAUDRY. Apparatus for continuous, large-volume suspended cell cultivation. Biotechnol. Bioeng. 13:457. 1971. 6. MOWAT, G.N. y W.G. CHAPMAN. Growth of foot-and-mouth disease virus in a fibroblastic cell line derived from hamster kidneys. Nature 194:253. 1962. 7. RAMOS, P.M., J.M. OBREGON, A. MALDONADO, N. NOGUERA y H. DELGADO. Producción de células BHK 21 clon 13 en suspensión: sistema utilizado en el Servicio de Vacuna Inactivada del Instituto de Investigaciones Veterinarias. 19 Convención Anual de la AsoVac (Resumen). Memorias, p.33. 1979. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||