|
RESUMEN
Se realizó un estudio
epidemiológico de la ocurrencia de fiebre aftosa (FA) en Venezuela,
durante el año 2003. La confirmación por laboratorio de 58 focos, la
dinámica de infección y la distribución en los cuatro bloques
geográficos, indicaron que ocurrió un brote de naturaleza
epizoótica, donde el 90% y el 10% de los focos fueron ocasionados
por los virus A24 y O1, respectivamente. El estudio filogenético de
las cepas aisladas, realizado por el Centro Panamericano de Fiebre
Aftosa, indicó que no se trataron de cepas exóticas para Sudamérica,
presentando una homología con las cepas vacunales A24 y O1 de 86% y
93%, respectivamente. Un análisis de las vacunaciones aplicadas
contra FA durante los años 2001 y 2002 demostró bajas coberturas de
vacunación en bovinos y predios (P<0,001), principalmente en los
bloques Llanero y Occidental; seguidos por el Oriental, lo que se
correspondió con la ocurrencia de focos, indicando un bajo estado
inmunitario de la población animal, particularmente en bovinos < de
2 años de edad, con un índice de riesgo relativo de 2,55. En el
bloque Centro-occidental se observó una cobertura de vacunación
mantenida, la cual pudiera explicar la baja ocurrencia de focos
(6,9%) en dicho bloque, reforzando la importancia de una vacunación
eficiente para la erradicación de la fiebre aftosa.
Palabras Clave: Fiebre aftosa; bovinos; epidemiología.
EPIDEMIOLOGICAL
STUDY OF FOOT AND MOUTH DISEASE IN VENEZUELA. 2003
SUMMARY
An epidemiological study was
carried out on the foot and mouth disease (FA) in Venezuela, during
2003. The occurrence of 58 outbreaks confirmed by laboratory,
dynamic of viral infection and its distribution into four geographic
areas of the country indicated that FMD was epizootic. FMD virus
serotypes A24 and O1 were confirmed causing the outbreaks in 90% and
10% respectively. The filogenetic study that was done by Panamerican
Center for Foot-and-Mouth Disease (PANAFTOSA) of isolated strains
showed that those strains were not exotic to South America,
presenting a homology with the vaccinal strains A24 and O1 of 86%
and 93%, respectively. Analysis of applied vaccination program
against FMD during the years 2001 and 2002 demonstrated low coverage
of vaccination in bovines and in the farms (P<0.001), meanly in the
Llanos and Western areas and followed by the Eastern, corresponding
with the occurrence of the focuses, which indicated a low immune
state of the animal population, particularly bovines < 2 years old,
showing a relative risk index of 2.55. It was observed a good steady
plan of vaccination that could explain the low occurrence of focuses
(6.9%) in the Center-west areas of the country, which remarcks how
important is an efficient program of vaccination to eradicate foot
and mouth disease.
Key Words: Foot and Mouth Disease; bovines; epidemiology.
INTRODUCCIÓN
La fiebre aftosa (FA) ha estado
presente en los 162 países miembros de la Organización Internacional
de Epizootias (OIE) (Correa et al., 2002b; OPS–OMS, 1998;
OPS–OMS, 2000). La creación en 1972 de la Comisión Suramericana de
Lucha contra la FA, y en 1987 del Plan Hemisférico de Erradicación
de la FA (PHEFA), suscrito por los países suramericanos, permitió
que Chile, en 1981, fuera el primer país de Suramérica en erradicar
la enfermedad y ser reconocido como país libre. Posteriormente,
Uruguay obtuvo este reconocimiento en 1996, seguido por Argentina y
norte de Colombia y Paraguay, en 1997. Así mismo, Brasil ha ido
incorporando zonas libres desde 1998 hasta el 2001 (Correa y López,
2002; Correa et al., 2002; Galleguillos, 2001; OPS–OMS, 2000;
Piñate, 1996).
El incremento del intercambio mundial de productos y subproductos de
origen bovino y la disminución de las coberturas de vacunación y la
eliminación de esta práctica, en algunos países certificados por la
OIE como libres de FA, favoreció en el año 2001, la ocurrencia de la
enfermedad en Europa y Sudamérica, afectando gran parte del
territorio de Argentina, Uruguay y algunos sectores del sur de
Brasil (Correa y López, 2002; Galleguillos, 2001; OIE, 2003;
Rweyemamu y Astudillo, 2002; Vallat, 2002). En el año 2003, de
acuerdo a las informaciones de la OIE, se presentaron focos en
Argentina, Ecuador, Bolivia y Paraguay, detectándose actividad de
los virus tipos A, O y C.
En Venezuela, desde su origen esta enfermedad se ha caracterizado
por ser de naturaleza enzoótica. En el año 1997, producto de las
experiencias exitosas en materia de erradicación realizadas en otros
países suramericanos, se dio inicio al Programa de Erradicación de
la Fiebre Aftosa (PEFA), en armonía con el PHEFA (Castro, 2000;
Piñate, 1996).
Este programa es coordinado por el Ministerio de Agricultura y
Tierras (MAT), a través del Servicio Autónomo de Sanidad
Agropecuaria (SASA), con el apoyo del Laboratorio de Enfermedades
Vesiculares - Centro Nacional de Investigaciones Agropecuarias (CENIAP)
- Instituto Nacional de Investigaciones Agrícolas (INIA), Maracay,
estado Aragua, el cual está adscrito al Ministerio de Ciencia y
Tecnología. En el PEFA se ejecutan diversas acciones, entre las
cuales figuran la vacunación sistemática de los bovinos en dos
ciclos al año, el control de la movilización interna de animales, la
intensificación de la vigilancia epidemiológica, la capacitación de
médicos veterinarios para el control de focos y la concienciación de
los productores sobre la enfermedad y los beneficios de su
erradicación (Castro, 2000; Castro y Dora, 2000; Piñate, 1996;
Sociedad Venezolana de Salud Pública, 2001).
Para mejorar la eficacia en la
planificación, seguimiento y evaluación de las acciones contempladas
en el PEFA, se dividió el territorio nacional en cuatro bloques
geográficos, a saber: Llanero (Amazonas, Apure, Barinas, Cojedes,
Guárico y Portuguesa), Occidental (Mérida, Táchira, Trujillo y
Zulia), Oriental (Anzoátegui, Bolívar, Delta Amacuro, Monagas, Nueva
Esparta y Sucre) y Centro-occidental (Aragua, Carabobo, Falcón,
Lara, Miranda, Yaracuy y Vargas).
Con la aplicación del PEFA, Venezuela logró un incremento mantenido
de las coberturas de vacunación durante los años 1998, 1999, 2000 y
2001, alcanzándose valores de 63%, 70,5%, 84%, y 90,6%,
respectivamente, los cuales permitieron disminuir la casuística de
la enfermedad a niveles considerables. Así mismo, logró ejecutar un
nuevo programa de control oficial de la vacuna antiaftosa, además de
un sistema para controlar la preservación de la calidad y
comercialización de las mismas, y aplicación en los bovinos (Castro
y Dora, 2000). Sin embargo, a finales del año 2002 se observó un
repunte de la enfermedad, que llegó a alcanzar características
epizoóticas durante el 2003, afectando la población bovina de varias
zonas del país.
El objetivo de este trabajo fue estudiar epidemiológicamente, el
comportamiento de fiebre aftosa en Venezuela durante el año 2003,
utilizando como elementos de análisis las características de la
enfermedad durante los años 2001 al 2003.
MATERIALES Y MÉTODOS
La información utilizada para el
estudio fue obtenida de los registros del Laboratorio de
Enfermedades Vesiculares y de los archivos de la Unidad de
Epidemiología del CENIAP – INIA; así como de la Oficina de Apoyo y
Vigilancia Epidemiológica del SASA – MAT, y del Centro Panamericano
de Fiebre Aftosa (PANAFTOSA) – OPS-OMS.
El estudio se fundamentó en la tabulación y el análisis de los datos
que sobre FA se registraron durante el año 2003, específicamente: el
número de focos con sospecha de FA, focos confirmados, tipos y
subtipos de virus identificados, análisis filogenético de las cepas
aisladas, y análisis de las coberturas de vacunación (2001 – 2002).
Las vacunaciones efectuadas durante el primer ciclo del año 2003 no
fueron consideradas, en razón a que en presencia de focos está
contraindicada la movilización y agrupamiento de animales por el
efecto potenciador que ocasiona sobre la difusión del virus. La
identificación de las cepas virales fue realizada por la técnica de
fijación de complemento (Alonso, 1986) y el análisis filogenético de
ellas mediante el protocolo desarrollado por Malirat y Bergmann
(2001). Se determinó la aparición de focos, evolución y distribución
geográfica de la actividad viral, tomando en consideración los
grupos etarios (< de 2 años y > de 2 años) y las coberturas de
vacunación por bovinos y por predios.
Se consideró como foco, toda unidad de explotación en la cual se
confirmó la presencia de casos de FA, y como caso, todos los
animales enfermos dentro de un foco, que mostraron salivación
excesiva y lesiones vesiculares o erosivas en boca, ubre o patas, de
acuerdo a la anamnesis reportada.
Análisis de los datos
Los datos se tabularon por entidades federales y por los cuatro
bloques geográficos establecidos en el PEFA. Para la ubicación
geográfica de los focos se consideraron los cuadrantes hemisféricos
locales, además de su distribución en el tiempo (Málaga, 1990;
OPS-OMS-BID, 1988). La tabulación se realizó empleando el programa
para epidemiología EpiInfo Versión 5 (CDC-OMS-OPS, 1992). La
comparación entre los porcentajes de bovinos y predios vacunados en
cada ciclo durante cada uno de los años relacionados con el evento
(2001, 2002), se realizó mediante la prueba de ji-cuadrado y se
estableció como nivel de significación el 1%.
Para determinar la existencia o no de diferencias entre grupos
etarios, se utilizó la información referente a la población total,
sana y enferma, y la distribución de esta última por grupos etarios
(< de 2 años y > de 2 años), procedente de cada uno de los predios
en los cuales hubo diagnóstico de FA por análisis de laboratorio. La
frecuencia de casos entre ambos grupos etarios se comparó mediante
la prueba de ji-cuadrado. Se calculó además el Índice de Riesgo
Relativo (Málaga, 1990; Thrusfield, 1990) y se evaluó su
significación estadística mediante la prueba de T y un nivel a de
0,01.
RESULTADOS Y DISCUSIÓN
Durante el año 2003, se registraron
151 fincas en las cuales se observaron bovinos con sintomatología
sospechosa de FA, ubicadas en 15 entidades federales. De acuerdo a
los resultados de laboratorio, se confirmó la existencia de 58 focos
de la enfermedad, siendo las cepas A24 y O1 las responsables del 90
y 10% de estos focos, respectivamente (Cuadro 1). Esta situación
mostró sin duda alguna, una actividad viral de naturaleza epizoótica
con respecto a los años 2001 y 2002, durante los cuales se
presentaron solo 6 y 9 focos respectivamente (Figuras 1 y 2). La
distribución de los focos en el país, por tipo de virus, se muestra
en la Figura 3. Este comportamiento de la enfermedad es usual cuando
existe un bajo estado inmunitario de las poblaciones bovinas, en
razón a la gran capacidad de difusión del virus de la FA (Acha y
Szyfres, 1989; Blood y Radostits; 1992; Correa y López, 2002;
Donalson y Alexandersen, 2002; Galleguillos, 2001; Kitching, 2002a).
|
CUADRO 1. Distribución de
focos de fiebre aftosa por entidad federal. Venezuela.
Año 2003. |
|
| Entidad
Federal |
Fincas con
sospecha de FA |
N° de focos
confirmados
(%) |
Tipos de virus |
| A24 |
O1 |
|
|
Anzoátegui |
1 |
0 |
0 |
0 |
|
Aragua |
7 |
0 |
0 |
0 |
|
Barinas |
42 |
24 (57,1) |
24 |
0 |
|
Bolívar |
18
|
10 (55,6) |
10 |
0 |
|
Carabobo |
1 |
0 |
0 |
0 |
|
Cojedes |
7 |
0 |
0 |
0 |
|
D. Amacuro |
2 |
2 (100,0) |
2 |
0 |
|
Guarico |
5 |
1 (20,0) |
1 |
0 |
|
Mérida |
15 |
7 (46,7) |
6 |
1 |
|
Monagas |
3 |
0 |
0 |
0 |
|
Portuguesa |
4 |
0 |
0 |
0 |
|
Táchira |
11 |
1 (9,1) |
1 |
0 |
|
Trujillo |
1 |
0 |
0 |
0 |
|
Yaracuy |
14 |
4 (28,6) |
0 |
4 |
|
Zulia |
20 |
9 (45,0) |
8 |
1 |
|
|
TOTAL |
151 |
58 (38,4)
|
52 |
6 |
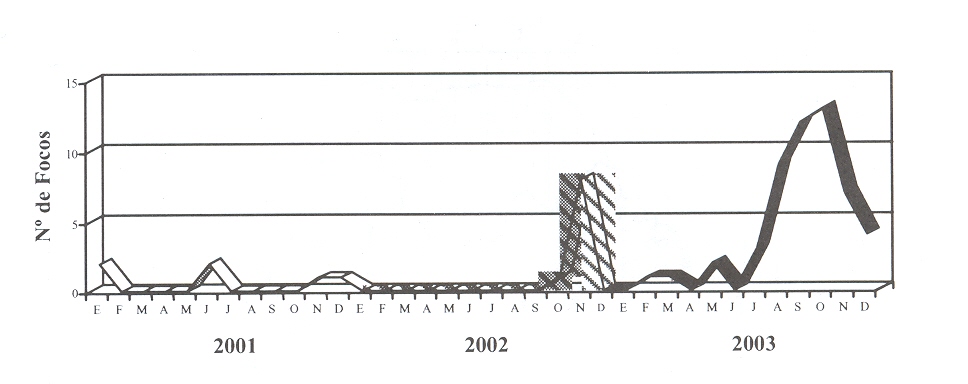 |
| FIGURA 1. Dinámica
de FA virus tipo A24. Venezuela. Período 2001-2003. |
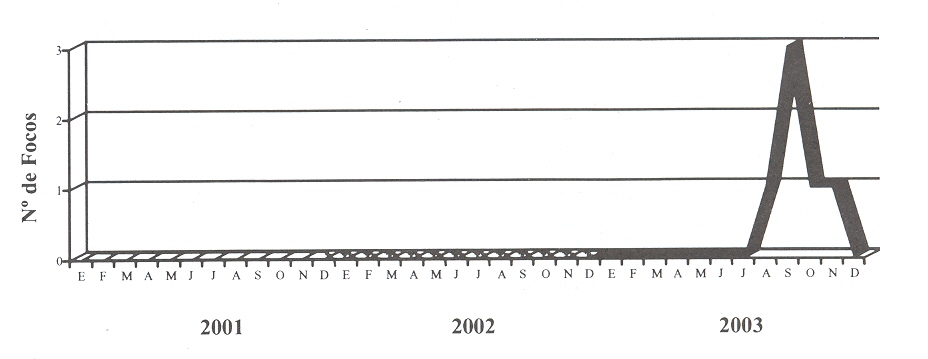 |
| FIGURA 2. Dinámica
de FA virus tipo O1. Venezuela. Período 2001-2003. |
FIGURA 3.
Distribución de focos de fiebre aftosa. Venezuela. Año 2003.
Debido al avance alcanzado por las
técnicas de biología molecular, en la actualidad se realiza una
evaluación mas precisa del grado de homología entre cepas virales.
En el caso de la fiebre aftosa, estos análisis se dirigen
principalmente a comparar secuencias genómicas de la región que
codifica para la proteína capsidal VP1, por ser polimórfica y jugar
un importante rol en la inmunogenicidad e infecciosidad de la
partícula viral, además de su papel dominante en la estructura de la
superficie del virus de FA (Malirat y Bergmann, 2001).
El análisis filogenético realizado por PANAFTOSA, se efectuó con
base al gen que codifica para esta proteína capsidal, sobre dos
cepas O1campos y tres de A24cruceiro, aisladas durante el año 2003,
y relacionándolas con otras cepas representativas de Sudamérica.
Este análisis indicó que las cepas O1 presentaron una homología de
99% entre ellas y con relación a la cepa vacunal, una homología de
93%. En el caso de las cepas A24, la homología entre ellas fue igual
o superior al 85%, y en relación con la cepa vacunal, igual o mayor
al 86%. El estudio determinó que se trataban de cepas endógenas de
Suramérica y estrechamente relacionadas en ambos subtipos, de
acuerdo a los criterios utilizados en estudios similares (Kitching,
1998; Malirat y Bergmann, 2001). La homología genómica encontrada
entre las cepas A24 y O1, y las correspondientes vacunales,
descartan la posibilidad de que se trate de cepas virales que no
pudieran ser controladas con las cepas utilizadas en la elaboración
de las vacunas aplicadas en Venezuela.
Con respecto a la distribución de focos por bloques geográficos, se
detectó la mayor ocurrencia en los bloques Llanero y Occidental, con
25 y 17 focos, seguido de los bloques Oriental y Centro-occidental
con 12 y 4 focos, respectivamente. En el Bloque Llanero, solamente
en los estados Barinas y Guárico, se registró el 43,1% del total de
los focos detectados en el país. Dentro del Bloque Occidental se
registró el 29,3%, siendo Trujillo el único estado de este bloque
que permaneció libre de FA. En el Bloque Oriental, el 20,7% del
total de los focos registrados, correspondió a los estados Bolívar y
Delta Amacuro. Finalmente, en el Bloque Centro-occidental se
registró el 6,9% de los focos, siendo Yaracuy el único estado
afectado en este bloque (Cuadro 2).
En relación a la dinámica y distribución de la actividad del tipo
A24, el foco índice ocurrió en el Bloque Occidental (estado Mérida),
en octubre de 2002, y posteriormente se diseminó dentro del mismo
bloque al estado Zulia, llegando a registrarse un total de nueve
focos entre ambos estados limítrofes. Durante el primer trimestre
del año 2003, se registró un foco en cada uno de estos estados y
posteriormente ocurrió un silencio de actividad de este virus que se
rompió entre el período de agosto a diciembre, cuando ocurrieron
nuevamente focos en ambos estados.
|
CUADRO 2. Distribución
de focos de fiebre aftosa por bloques geográficos.
Venezuela. Año 2003. |
|
| Bloques Geográficos |
Fincas con
sospecha
de FA |
N°
de focos
confirmados
(%) |
Focos en relación
a la ocurrencia
total (%) |
|
|
Llanero |
58 |
25(43,1) |
43,1 |
|
Occidental |
47 |
17(36,2) |
29,3 |
|
Oriental |
24 |
12(50,0) |
20,7 |
|
Centro-occidental |
22 |
4 (18,2) |
6,9 |
|
|
Total |
151 |
58 (38,4) |
100,0 |
En el mes de mayo se registraron los primeros focos en el Bloque
Oriental, específicamente en los estados Bolívar y Delta Amacuro,
manteniéndose posteriormente la ocurrencia de focos durante el resto
del año, particularmente en el estado Bolívar. A partir del mes de
julio, se inicia la actividad epizoótica en el Bloque Llanero
(estado Barinas), registrándose durante el resto del año numerosos
focos. El grado de difusión fue de tal magnitud que se afectaron
seis de sus 11 municipios, mientras que en el estado Guárico, otro
integrante de este bloque, se registró un solo foco durante el mes
de julio.
En cuanto al tipo O1, se detectó el primer foco en el Bloque
Centro-occidental (estado Yaracuy) en el mes de agosto, único estado
de este bloque con registro de FA para el año analizado. El evento
se presentó en una granja de ganado porcino y posteriormente en
varios establecimientos de ganado bovino, durante los meses de
agosto y septiembre. Seguidamente, en octubre y noviembre se
registraron dos focos ocasionados por este virus en el Bloque
Occidental, concretamente en los estados Mérida y Zulia (Figura 3).
Tomando en consideración que los cerdos son menos susceptibles que
los bovinos a la infección de FA por transmisión aérea (Donalson y
Alexandersen, 2002; Kitching, 2002a; Kitching y Alexandersen, 2002),
sería probable que el foco primario se haya originado en una finca
de ganadería bovina. El hecho de que en los cerdos no ocurren
infecciones persistentes de FA en el tracto esófago-faríngeo (Kitching,
2002b), refuerza la hipótesis anterior. No obstante, Mezencio et
al. (1999), señalaron hallazgos por pruebas de biología
molecular, que pudieran hacer pensar que en los cerdos
convalecientes existe infección persistente por cortos períodos de
tiempo, después de su recuperación (Sutmoller y Gómes, 1982).
La mayoría de los focos por virus O1, se concentraron en Yaracuy, es
decir, que no tuvo mayor diseminación a otros estados, posiblemente
por la mayor antigenicidad del virus O1 con relación al A24 (Casas
et al., 1990), y a las medidas de control implementadas por
los entes oficiales regionales.
Para explicar el comportamiento de la enfermedad, es preciso
relacionar la ocurrencia de focos con el estado inmunitario de las
poblaciones bovinas, en los cuatro bloques geográficos,
principalmente en los bloques Llanero y Occidental donde ocurrió la
mayoría de los focos. En el Bloque Llanero destaca una disminución
del porcentaje de cobertura de vacunación de bovinos de 90,3% a
87,4% entre el I y II ciclo del año 2001, situación que se agudiza
en el año 2002, con un descenso de 88,4% a 77,0%, en los ciclos de
vacunación antes referidos (Cuadro 3).
En cuanto al Bloque Occidental, en el año 2001, prácticamente no
ocurrió variación entre las coberturas de vacunación de ambos ciclos
(96,7% y 93,7%), mientras que en el año 2002, se registró un
descenso bien marcado de 95,2% a 79,6%. Esta situación ha podido
conducir a que existiese una cifra elevada de animales susceptibles
en el I ciclo del año 2003.
| CUADRO 3.
Cobertura de vacunación de bovinos contra fiebre aftosa.
Venezuela. Años 2001-2002. |
|
| Años |
Bloque
geográfico |
I Ciclo |
II Ciclo |
P |
|
|
No
Vacunados |
Vacunados |
No
Vacunados |
Vacunados |
|
|
2001 |
Llanero |
603.104 |
5.628.567 (90,3) |
778.060 |
5.406.927 (87,4) |
≤0,001 |
| Occidental |
96.265 |
2.789.425 (96,7) |
176.043 |
2.642.174 (93,7) |
≤0,001 |
| Oriental |
180.685 |
1.265.290 (87,5) |
169.779 |
1.259.483 (88,1) |
≤0,001 |
| Centro-occidental
|
68.662 |
960.739 (93,3) |
113.579 |
1.179.092 (91,2) |
≤0,001 |
|
| |
Total |
948.716 |
10.644.021(91,8) |
1.237.461 |
10.487.676(89,4) |
≤0,001 |
|
|
2002 |
Llanero |
720.107 |
5.511.925 (88,4) |
1.334.057 |
4.750.482 (77,0) |
≤0,001 |
|
Occidental |
138.248 |
2.714.366 (95,2) |
595.637 |
2.249.680 (79,6) |
≤0,001 |
|
Oriental |
161.811 |
1.271.933 (88,7) |
276.047 |
1.099.328 (79,9) |
≤0,001 |
|
Centro-occidental |
82.516 |
924.670 (91,8) |
124.916 |
1.119.930 (89,9) |
≤0,001 |
|
| |
Total |
1.102.682 |
10.422.894(90,4) |
2.330.657 |
9.219.420 (79,8) |
≤0,001 |
|
En el Bloque Oriental, las coberturas de vacunación tuvieron un
comportamiento similar a la de los bloques Llanero y Occidental,
mientras que se mantuvieron alrededor del 90% en el Bloque
Centro-occidental, donde apenas se registró el 6,9% del total de
focos. La ocurrencia elevada de focos de FA, particularmente en los
bloques con menor cobertura de vacunación, es indicativa de un
deficiente estado inmunitario contra las cepas actuantes. Estas
diferencias de vacunación de bovinos, entre ambos ciclos, fueron
estadísticamente significativas en todos los bloques.
En relación a la vacunación por
predios (Cuadro 4), se observaron en el año 2001 coberturas bajas de
vacunación en ambos ciclos, de alrededor del 70% en los bloques
Llanero y Oriental; no así para los bloques Occidental y
Centro-occidental, donde las coberturas superaron el 80%. En el año
2002, para el II ciclo de vacunación, se presentó una caída brusca
en las coberturas de vacunación de alrededor del 60% (P<0,001), en
los bloques Llanero, Occidental y Oriental, en los cuales se
registraron las mayores ocurrencias de focos de FA. Contrariamente,
y a similitud del año anterior, en el Bloque Centro-occidental las
coberturas de vacunación en ambos ciclos, estuvieron alrededor del
80% (P=0,09), lo que ratifica un buen estado inmunitario de la
población bovina de este bloque por una mantenida cobertura vacunal.
Las bajas coberturas de vacunación por predios durante ambos ciclos
de los años 2001 y 2002, particularmente en los bloques Llanero,
Occidental y Oriental comprometieron la inmunidad de la población
bovina, condición importante para evitar la replicación del virus en
los rebaños (Acha y Szyfres, 1989; Blood y Radostits, 1992; Casas
et al., 1990). Es aceptado que la inmunidad conferida por la
vacuna supera los 12 meses (Allende, 2001; Centro Panamericano de
Fiebre Aftosa, 1981), no obstante las fallas de vacunación por dos
años consecutivos pudieran explicar el repunte de la enfermedad.
Toda esta situación incrementó la cantidad de animales
desprotegidos, de susceptibles y la posibilidad de diseminación
viral, debido al número de fincas que no fueron incluidas en el
programa de vacunación, de acuerdo a la estrategia recomendada por
el PEFA, que venía funcionando adecuadamente desde el año 1998,
habiéndose logrado un incremento de las coberturas vacunales
anuales, escenario que se mantuvo hasta el año 2001 (Castro y Dora,
2000; 2001).
Si tomamos en consideración que todas las vacunas utilizadas en el
programa cumplieron con el nivel mínimo exigido por los patrones
internacionales (OIE, 2000), debió garantizarse una inmunidad
adecuada y sostenida, de haberse mantenido la frecuencia de
vacunación. Sin embargo, no se puede dejar de considerar la
posibilidad de que hubiesen ocurrido fallas en la cadena de frío,
durante la comercialización y aplicación del biológico, que pudieran
haber afectado en algún grado su eficacia (Sutmoller y Casas, 2002).
|
CUADRO 4. Cobertura de vacunación
por predios contra fiebre aftosa. Venezuela. Años 2001-2002. |
|
| Años |
Bloque
geográfico |
I Ciclo |
II Ciclo |
P |
|
|
No
Vacunados |
Vacunados |
No
Vacunados |
Vacunados |
|
|
2001 |
Llanero |
11.230 |
3134 (73,6) |
11.858 |
30.688 (72,1) |
≤0,001 |
| Occidental |
2.525 |
22.470 (89,9) |
4.798 |
20.835 (81,2) |
≤0,001 |
| Oriental |
3.147 |
7.706 (70,8) |
2.854 |
7.895 (73,4) |
≤0,001 |
| Centro-occidental
|
1.795 |
10.349 (85,2) |
2.365 |
10.830 (82,0) |
≤0,001 |
|
| |
Total |
18.697 |
71.874(79,3) |
21.879 |
70.248 (76,3) |
≤0,001 |
|
|
2002 |
Llanero |
10.699 |
31.006 (88,3) |
16.891 |
24.899 (63,5) |
≤0,001 |
|
Occidental |
2.908 |
21.998 (88,3) |
9.084 |
15.815 (64,7) |
≤0,001 |
|
Oriental |
2.683 |
7.963 (74,8) |
3.721 |
6.831(80,4) |
≤0,001 |
|
Centro-occidental |
2.444 |
9.490 (79,5) |
2.453 |
10.051 (80,4) |
0,09(NS) |
|
| |
Total |
18.734 |
70.457 (79,0) |
30.359 |
59.306 (66,1) |
≤0,001 |
|
Analizando la ocurrencia de focos de FA por grupos etarios, se
observa una diferencia significativa entre los dos grupos
(P<0,0001), ocurriendo una mayor frecuencia en el grupo < de 2 años
(Cuadro 5). El valor del Índice de Riesgo Relativo (IRR = 2,55)
demostró una mayor susceptibilidad (155%) en el grupo de animales
jóvenes, confirmando la hipótesis de una deficiente cobertura
vacunal. Se debe tener presente que en los predios, los bovinos < de
2 años tienen menor oportunidad de ser vacunados, razón por lo que
generalmente constituyen la población más susceptible,
particularmente si no se cumple con la cobertura en los ciclos de
vacunación establecidos.
|
CUADRO 5. Ocurrencia de fiebre aftosa en relación a grupos etarios.
Venezuela. Año 2003. |
|
| Grupos etarios |
Bovinos en el foco |
|
| No
Enfermos |
Enfermos |
Total |
|
| < de 2 años
|
8.152 |
2.128 (20,7%) |
10.280 |
| > de 2 años
|
7.170 |
733 (9,3%) |
7.903 |
|
| Total
|
15.322 |
2.861 |
18.183 |
|
| P < 0,0001 IRR: 2,55 (P< 0,01) |
La elevada homología de las cepas vacunales con las actuantes en el
brote, la mantenida cobertura vacunal en el Bloque Centro-occidental
y la baja ocurrencia de focos (6,9%) en el mismo, nos conduce a
pensar que la deficiente cobertura de vacunación, en bovinos y
predios en los otros bloques, durante los años 2001 y 2002, fueron
determinantes en la aparición de los focos a finales del 2002 y en
el desarrollo del brote durante el 2003, afectando mayormente a los
animales < de 2 años.
AGRADECIMIENTO
Al personal técnico del Laboratorio
de Enfermedades Vesiculares, Sanidad Animal y CENIAP-INIA. Maracay.
Flor Peña y José M. Obregón.
REFERENCIAS BIBLIOGRÁFICAS
ACHA, P. y B. SZYFRES. 1989. Zoonosis
y enfermedades transmisibles comunes al hombre y a los animales.
OPS–OMS. 2° ed., Washington. Publicación Científica N° 503. p.
394-401.
ALLENDE, R. M. 2001. Normas
internacionales recomendadas para control de vacuna antiaftosa. In:
Memorias VII Seminario Internacional de Control de vacuna
antiaftosa. Centro Panamericano de Fiebre Aftosa. Río de Janeiro.
Brasil. p. 27-35.
ALONSO, F. A. 1986. Manual de
diagnóstico de enfermedades vesiculares. Serie de Manuales
didácticos. Nº 15. OPS-OMS. 50 p.
BLOOD, D. y O. RADOSTITS. 1992.
Medicina Veterinaria. Interamericana. McGraw-Hill, 7° ed. Madrid. p.
887-894.
CASAS O. R., P. AUGÉ, D. ABARACÓN, I.
GÓMES, A. ALONSO, J. MESQUITA y G. DARSIE. 1990. Producción y
control de vacunas antiaftosa con adyuvante oleoso, en el Centro
Panamericano de Fiebre Aftosa y en el Laboratorio Regional de Apoyo
Animal del Ministerio de Agricultura y Reforma Agraria, Brasil. Bol.
Centr. Panam. Fiebre Aftosa. 56:3-51.
CASTRO, J. 2000. Situación actual de
la erradicación de la fiebre aftosa en Venezuela. In: Memorias VII
Reunión de evaluación de las comisiones regionales para la
erradicación de la fiebre aftosa. Ministerio de Producción y
Comercio. Servicio Autónomo de Sanidad Agropecuaria. San Cristóbal.
Estado Táchira. Venezuela. 22 p.
CASTRO, J. y F. DORA. 2000. Manual de
procedimientos para la atención de un foco de Fiebre Aftosa.
Ministerio de Producción y Comercio. Servicio Autónomo de Sanidad
Agropecuaria. Venezuela. 23 p.
CASTRO, J. y F. DORA. 2001.
Información Básica sobre la situación de la salud pública
veterinaria en Venezuela. Manual OPS-OMS. Caracas. 122 p.
CDC-OMS-OPS. 1992. Epi Info, Versión
5. Epidemiología con Microordenadores. Atlanta, USA. 243 p.
CENTRO PANAMERICANO DE FIEBRE
AFTOSA–OPS–OMS. 1981. Informe final sobre evaluación de proyectos de
vacunación de bovinos con vacuna antiaftosa con adyuvante oleoso del
Centro Panamericano de fiebre aftosa. Brasil. p. 33-48.
CORREA M. E. y A. LÓPEZ. 2002. Control
de la fiebre aftosa: la experiencia americana. Rev. Sci. Tech. Off.
Int. Epiz. 21(3):689-694.
CORREA M. E., V. SARAIVA y V.
ASTUDILLO. 2002. Panorámica de la situación de la Fiebre Aftosa en
los países de Sudamérica y métodos de control y erradicación. Rev.
Sci. Tech. Off. Int. Epiz. 21(3):429-436.
DONALSON, A. y S. ALEXANDERSEN. 2002.
Predicción de la propagación de la fiebre aftosa por transmisión
aérea del virus. Rev. Sci. Tech. Off. Int. Epiz. 21 (3): 569-575.
GALLEGUILLOS, H. 2001. Una experiencia
sobre la vigilancia y prevención de la fiebre aftosa en un país
libre de fiebre aftosa. In: VII Seminario Internacional de Control
de vacuna antiaftosa. Centro Panamericano de Fiebre Aftosa. Río de
Janeiro, Brasil. p. 43-45.
KITCHING, R. P. 1998. Recent history
of foot and mouth disease. J. Comp. Path. 1(18):89-108.
KITCHING, R. P. 2002a. Variación de
las manifestaciones clínicas de la Fiebre Aftosa en los bovinos.
Rev. Sci. Tech. Off. Int. Epiz. 21(3):499-504.
KITCHING, R. P. 2002b. Detección de
ejemplares portadores del virus de la fiebre aftosa o con infección
subclínica, y discriminación entre estos animales y los vacunados.
Rev. Sci. Tech. Off. Iint. Epiz. 21 (3):531-538.
KITCHING, R. P. y S. ALEXANDERSEN.
2002. Variación de las manifestaciones clínicas de la fiebre aftosa:
porcinos. Rev. Sci. Tech. Off. Int. Epiz. 21 (3):513-518.
MÁLAGA, H. 1990. Epidemiología
Veterinaria. Ediciones de la Universidad del Zulia. Ediluz.
Maracaibo. Venezuela. p. 47-71.
MALIRAT, V. y I. BERGMANN. 2001.
Epidemiología molecular del virus de la fiebre aftosa en América del
sur. In: VII Seminario Internacional de Control de vacuna
antiaftosa. Centro Panamericano de Fiebre Aftosa. Río de Janeiro,
Brasil. p. 24-26.
MEZENCIO, J., G. BABCOCK, E. KRAMER y
F. BROWN. 1999. Evidence for the persistence of foot-and-mouth
disease virus in pigs. Vet. J. 157:213-217.
OIE. 2000. Manual of standards for
diagnostics tests and vaccines. Part 2. List A. Chapter 2.1.1. p.
47-50.
OIE. 2003. Estatus zoosanitario
oficial: Lista de los países libres de fiebre aftosa.
http://www.oie.int/
OPS-OMS-BID. 1988. Caracterización de
los ecosistemas de fiebre aftosa. In: Vigilancia Epidemiológica.
Vol. II. p. 533-628.
OPS-OMS. 1998. La erradicación de la
fiebre aftosa en América del Sur. Boletín Epidemiológico / OPS
19(2):14-15.
OPS-OMS. 2000. Situación de la fiebre
aftosa en América del Sur. Boletín Epidemiológico / OPS. 21(3):9.
PIÑATE, P. 1996. De la lucha contra la
fiebre aftosa en el mundo, Venezuela y Sudamérica. Comisión
Venezolana para la erradicación de la fiebre aftosa (COVEFA).
Caracas. 27 p.
RWEYEMAMU, M. M. y V. ASTUDILLO. 2002.
Las perspectivas de lucha contra la fiebre aftosa a escala mundial.
Rev. Sci. Tech. Off. Int. Epiz., 21 (3):765-773.
SOCIEDAD VENEZOLANA DE SALUD PÚBLICA.
2001. Situación actual de la erradicación de la Fiebre Aftosa en
Venezuela. Boletín informativo. Año 16. N° 1, 2 p.
SUTMOLLER, P. y R. CASAS. 2002.
Consecuencias de los casos asintomáticos de fiebre aftosa
(infecciones subclínicas y portadores) para el control de la
enfermedad. Rev. Sci. Tech. Off. Int. Epiz., 21(3):519-529.
SUTMOLLER, P. y I. GOMES. 1982.
Aspectos tácticos y operativos del uso masivo de la vacuna de
adyuvante oleoso a nivel de campo. In: Seminario de divulgación de
los mecanismos técnicos y operativos para el uso de la vacuna con
adyuvante oleoso en los programas de lucha contra la fiebre aftosa
en América del Sur. OPS–OMS - Centro Panamericano de Fiebre Aftosa.
Brasil. 29 p.
THRUSFIELD, 1990. Epidemiología
veterinaria. Editorial ACRIBIA, S. A. Zaragoza. p. 177-190.
VALLAT, B. 2002. Fiebre aftosa:
afrontar los nuevos dilemas. Prólogo. Rev. Sci. Tech. Off. Int.
Epiz., 21(3):421-423. |

