|
Veterinaria Trop. 28(1): 79-92.2003 COMPORTAMIENTO PARASITOLÓGICO, CLÍNICO y HEMATOLÓGICO EN OVINOS INFECTADOS EXPERIMENTALMENTE CON UN AISLADO VENEZOLANO DE Trypanosoma vivax Claribel E. Suárez Pellín*, Francisco A. García González**, Guadalupe Baldizán** y Franklin F. Mújica Linarez* *Profesores. Universidad Centroccidental "Lisandro Alvarado".Barquisimeto, estado Lara, Venezuela. **Profesores. Universidad Central de Venezuela. Recibido: junio 09, 2004. |
||||||||
|
RESUMEN El Trypanosoma vivax es el agente causal de una de las formas de tripanosomiasis de rumiantes más patógena y geográficamente diseminada. El presente trabajo tuvo como objetivo estudiar el efecto de la infección experimental con un aislado venezolano de T. vivax, sobre parámetros parasitológicos, clínicos y hematológicos en 15 ovinos machos, mestizos (West African y Persa Cabeza Negra). De estos animales, aleatoriamente se seleccionaron 10 para conformar el grupo infectado, y cinco animales permanecieron como controles no infectados. La infección experimental se realizó inoculando 2 ml de sangre, por vía intravenosa, conteniendo l,3x l06 Tryp/ml. Durante 57 días se evaluaron las variables: temperatura, parasitemia, signos clínicos, peso corporal, hematocrito (Ht), hemoglobina (Hb) Y plaquetas. En este período de tiempo los animales infectados manifestaron una parasitemia ondulante y dos fases de la enfermedad: una fase aguda y una subaguda. Los signos clínicos predominantes fueron: fiebre remitente, palidez de las mucosas, depresión, mal aspecto del pelaje, inflamación testicular, enflaquecimiento progresivo, secreción nasal y ocular sero-mucosa y dificultad respiratoria. Durante lE fase aguda de la enfermedad se presentó una disminución acelerada en los valore! promedios del Ht, Hb Y número de plaquetas. La fase subaguda se caracterizó por e mantenimiento de los valores promedios del Ht y Hb a bajos niveles, con menores fluctua ciones; tendencia a la recuperación o elevación del número de plaquetas. Este estudio aporta elementos importantes que permiten caracterizar el comportamiento patogénico de aislados de T. vivax en Venezuela. Palabras Clave: Trypanosoma vivax; tripanosomiasis; ovinos; hematología.
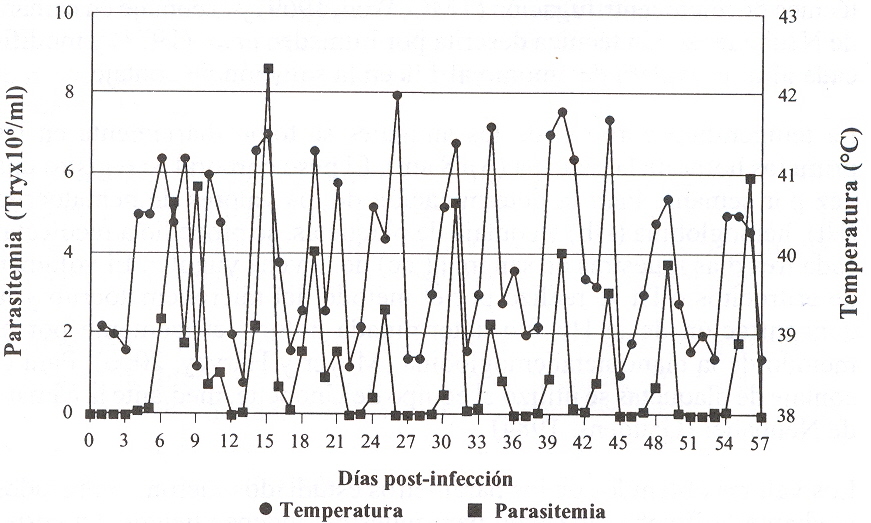
INTRODUCCIÓN La tripanosomiasis es una enfermedad debilitante y comúnmente fatal de los animales domésticos, especialmente en bovinos y pequeños rumiantes. Es ocasionada por varias especies de tripanosomas, de los cuales el Trypanosoma vivax es considerado como el agente causal de mayor importancia y distribución de la tripanosomiasis en rumiantes domésticos y silvestres en Sur América (Dávila y Silva, 2000). La enfermedad tiene un gran impacto sobre la productividad de los animales afectados en áreas endémicas, donde algunas veces aumenta a niveles epidémicos. La tripanosomiasis se ha estudiado principalmente en bovinos, los cuales son considerados como los principales hospedado res afectados por esta especie parasitaria (Hoare, 1972). En contraste, la tripanosomiasis no ha sido apreciada como una entidad nosológica importante en pequeños rumiantes domésticos, aún cuando estudios epidemiológicos en Venezuela, señalan seroprevalencias variables para T. vivax, que oscilan desde 9,75% hasta 62,3% (Roa et al., 1998; Tamasaukas et al., 1998), así como la aparición de brotes de esta enfermedad, con serias implicaciones económicas y sanitarias (García et al., 2002). De igual manera, destacan investigaciones sobre infecciones experimentales de T. vivax en ovinos y caprino s que demuestran que éstos pueden ser severamente afectados (Mavare, 1996; Sandoval, 1994). Los pequeños rumiantes pueden ser importantes reservorios de la infección, a partir de los cuales puede pasar al ganado vacuno y, por ser animales de menor costo y más fácil manejo, son también utilizados como modelo experimental para el estudio de la tripanosomiasis bovina. La importancia de la tripanosomiasis es aún mayor debido a la imperiosa necesidad de incrementar la producción de proteína de origen animal para el consumo humano. Estos aspectos evidencian la necesidad de realizar investigaciones con aislados de T. vivax en ovinos, a fin de caracterizadas patogénicamente. El objetivo de la investigación fue evaluar el comportamiento parasitológico y las alteraciones clínicas y hematológicas en ovinos infectados experimentalmente con un aislado de T. vivax de Venezuela. MATERIALES Y MÉTODOS Los animales experimentales estuvieron constituidos por 15 ovino s machos, mestizos (Persa Cabeza Negra y West-African), con edad comprendida entre 1 a 2 años. Todos los ovinos fueron desparasitados con Clorhidrato de Levamisol y vacunados con una bacterina Triple (Clostridium chauvoei, Cl. septicum y Pasteurella multocida). Los animales fueron confinados enjaulas cubiertas con malla anti-mosquito y recibieron una alimentación basada en pasto, heno, alimento concentrado con sales minerales yagua ad libitum. El ensayo se realizó en dos fases, una que comprendió el período de preinfección (1 semana) y la otra el período de infección (57 días). El material parasitológico utilizado en la infección experimental se obtuvo de un aislado de T. vivax, proveniente de un bovino de Tucacas, estado Falcón, criopreservado en nitrógeno líquido a -196°C según la técnica descrita por Espinoza y Tortolero (1990). El inóculo consistió en 2 ml de sangre conteniendo 1,3xl06 Tryp/ml, por vía intravenosa. El grupo infectado (GI) estuvo confonnado por 10 animales, mientras que 5 ovinos permanecieron como grupo control no infectado (GC). Los niveles de parasitemia fueron estimados diariamente utilizando la técnica de microcentrifugación (TMC; Woo, 1969) y el contaje en cámara de Neubauer según técnica descrita por Lumsden et al.,(1973) y modificada al usar oxalato de amonio al 1% en la solución de contaje. La temperatura corporal de los animales se tomó diariamente en las primeras horas de la mañana (6 a 8 am). El peso corporal se registró una vez por semana. Para la detenninación de los valores de hematocrito (Ht), hemoglobina (Hb) y contaje de plaquetas, se procedió a recolectar cada tres días muestras de sangre (1 cc) de la vena yugular. El volumen de eritrocitos o Ht se realizó por el método del microhematocrito y la concentración de la Hb fue detenninada colorimétricamente por el método de la cianometahemoglobina (Meyer y Harvey, 2000). Para el contaje de plaquetas se utilizó el equipo de Unopette, mediante la cámara de Neubauer (Gaudens, 1984) Los valores obtenidos de los parámetros estudiados fueron comparados mediante la Prueba de Tukey para muestras independientes. La correlación entre las variables estudiadas se realizó por el Coeficiente de Correlación de Pearson. Para todos los análisis se utilizó un nivel de significancia máximo del 5% (P<0,05). RESULTADOS Y DISCUSIÓN En el transcurso de este estudio, los ovinos del grupo control manifestaron valores de las variables estudiadas, dentro de los rangos normales referenciales (Meyer y Harvey, 2000). Una vez detectado el parásito en sangre, los animales del grupo infectado mostraron un aumento significativo (P<0,001) en los valores promedio de la temperatura corporal el día 6 de la infección, que coincidió con el primer pico de parasitemia. Los valores promedio de temperatura del grupo infectado oscilaron entre 39,19±0,61 °C y 40,93±0,73 °C. Se evidenció una variación individual de la temperatura corporal, con períodos piréticos intercalados por períodos apiréticos (Figura 1). El período de incubación osciló entre 4 y 5 días de post-infección (PI), aproximándose con lo señalado en infecciones con aislados venezolanos de T. vivax en bovinos, ovino s y caprinos (Espinoza, 1988; Mavare, 1996; Sandoval, 1994). El primer pico de parasitemia apareció entre los días 6 y 8 PI. En el transcurso del ensayo se observó en los ovinos infectados una parasitemia de tipo ondulante, con períodos altemos parasitémicos y aparasitémicos de duración variable.
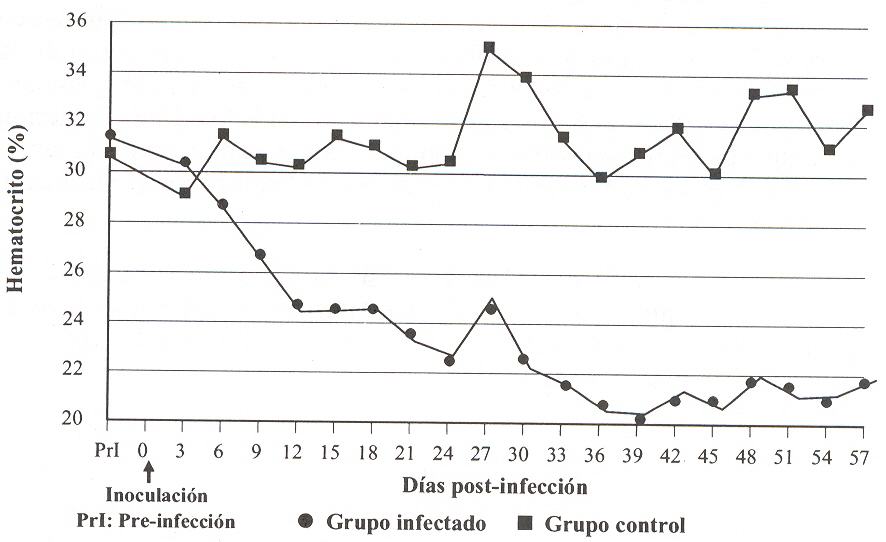
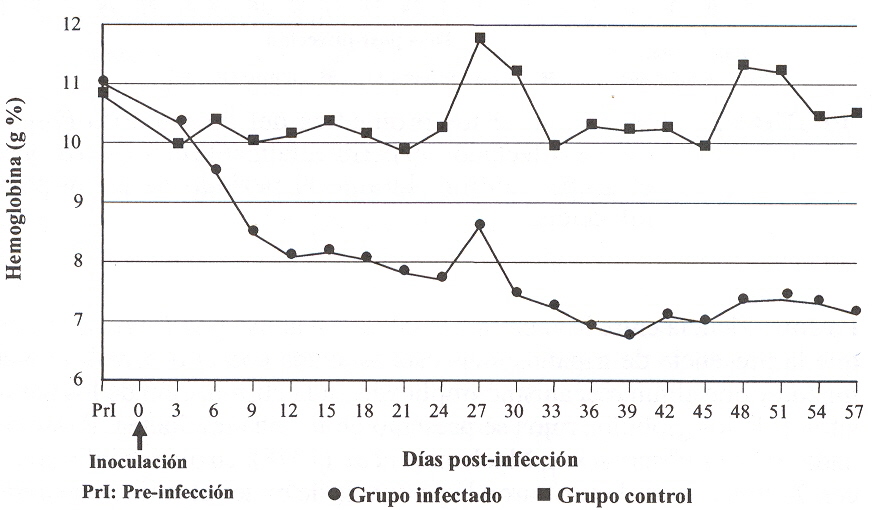
Las parasitemias fueron detectables hasta el final del período de muestreo y se evidenciaron entre 7 y 12 picos de parasitemia, con niveles que fluctuaron entre 25 x 103 y 44,5 x 106 Tryp/ml. En la mayoría de los animales infectados, las alzas térmicas coincidieron con los picos de la parasitemia (Figura 1), mientras que en algunos casos, los estados febriles no se asociaron con la presencia de tripanosomas circulantes, presentándose temperaturas normales con altas parasitemias, especialmente durante la 7ma y 8va semana PI. La estrecha relación entre hi aparición del primer aumento de la temperatura corporal y la presencia de los parásitos en la sangre, ha sido reseñada en estudios sobre tripanosomiasis experimental en ovinos y caprinos ocasionada por el T. vivax (Mavare, 1996, Sandoval, 1994). No obstante, un aumento de la temperatura corporal puede o no reflejar el grado de parasitemia (Stephen, 1986), tal como lo evidenciaron Katunguka et al., (1992), al no encontrar una correlación clara entre estas dos variables en infecciones por T. congolense en ovinos y Espinoza (1988), utilizando bovinos infectados con T. vivax. La divergencia obtenida pudiera ser atribuida a la especificidad de acción de la especie y a la fase de la enfermedad. Durante el curso de infección por T. vivax, se distinguieron dos estados claramente definidos de la enfermedad: una forma aguda, que se correspondió con las primeras 4 a 5 semanas PI, y una subaguda, que comprendió desde la 6ta a la 8va semana de PI. Estas fases se determinaron por la diferente proporción en que acontecieron algunos cambios y se asemeja a las fases reconocidas por Mavare (1996) y Sandoval (1994). La duración de este ensayo no permitió la observación de la fase crónica de la enfermedad. Los signos clínicos se caracterizaron por fiebre de tipo remitente, depresión, anorexia o inapetencia, mucosas pálidas, pelo hirsuto, secreción ocular serosa y secreción nasal sero-mucosa, estado físico desmejorado, debilidad general, depresión e indiferencia, pérdida de peso y enflaquecimiento progresivo, edemas en testículo, región perianal y perineal, inflamación testicular, incoordinación, disnea, espasmos, postración y muerte. Los signos clínicos fueron más evidentes en el segundo mes de la infección, período en el cual los animales presentaron una condición física deteriorada, muriendo 2 ovinos el día 42 y 56 PI, presentando elevadas parasitemias antes de la muerte. Las manifestaciones clínicas de la enfermedad, y la muerte de 2 ovino s infectados durante la fase subaguda de la enfermedad, reflejaron que esta cepa de T. vivax, presentó una moderada patogenicidad. Un comportamiento patógeno similar fue observado en ovinos y caprinos infectados experimentalmente con aislados venezolanos de T. vivax (Mavare, 1996; Sandoval, 1994). Estas observaciones contrastan con la opinión de Shaw y Lainson (1972), quienes afirman que en Sur América la enfermedad ocasionada por el T. vivax en los rumiantes es predominantemente crónica, con manifestaciones clínicas referidas a emaciación progresiva, anemia, aumento variable de nódulos linfáticos, con muertes observadas solo ocasionalmente. Los ovino s infectados manifestaron una evidente pérdida del peso, especialmente durante la fase subaguda de la enfermedad. Esta alteración comenzó a hacerse evidente y significativa (P<0,05) después del día 15 PI Y desde el día 39 PI las diferencias resultaron altamente significativas (P<0,01) hasta el final del ensayo. El 60% de los animales infectados con el aislado de T. vivax manifestaron una pérdida gradual de peso con relación al peso inicial, que alcanzó un máximo de 26,9% al finalizar el ensayo. Los ovinos restantes del GI lograron una ligera ganancia en el peso o mantuvieron su peso inicial, mientras que los ovinos del GC evidenciaron una ganancia en el peso corporal. Pérdidas significativas del peso han sido señaladas por Sandoval (1994), y Mavare (1996) en ovinos y caprinos infectados con aislados venezolanos de T. vivax. En contraste, otros investigadores no detectaron pérdida de peso, pero sí una reducción significativa de la ganancia de peso en bovinos infectados con T. congolense (Osaer et al., 1999), e incluso con aumento normal de peso en ovinos infectados con esta misma especie parasitaria (Katunguka et al., 1992). Por lo tanto, se puede inferir que el T. vivax utilizado en el trabajo exhibió un comportamiento patogénico que afectó la salud de los ovinos inoculados, reflejada en parte por la pérdida de peso. Luego de la inoculación experimental con T. vivax, sucedió un rápido descenso en los valores de Ht y Hb de los animales infectados, que fue más notorio durante los primeros 12 días de la inoculación (Figuras 2 y 3), a partir de los cuales se detectaron diferencias altamente significativas (p<0,01). La disminución se mantiene en forma progresiva hasta el día 39 PI, cuando alcanza su mínimo valor (Ht: 20,73±3,73 % y Hb: 6,74±1,37 g%) y posteriormente se mantiene a bajos valores con menores fluctuaciones. Alteraciones referidas a la disminución del Ht y concentración de Hb se han citado en investigaciones sobre tripanosomiasis ocasionada por T. vivax en rumiantes (Tamasaukas et al., 1998; Espinoza et al., 2000; Waiswa y Katunguka,2004).
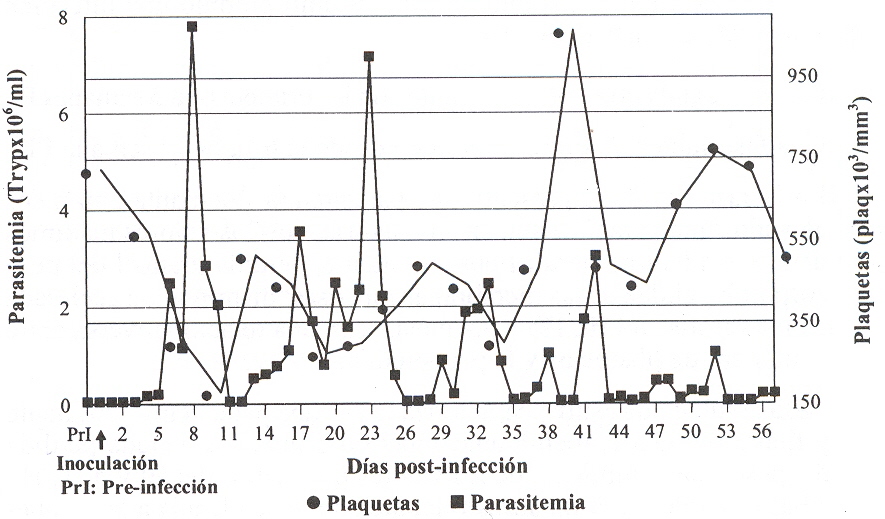
La coincidencia entre la anemia y la infección activa por T. vivax, indica que la presencia de tripanosomas está asociada con el desarrollo de la misma y que algún mecanismo implicado en la eliminación de los parásitos y de los glóbulos rojos se presentó en fonna simultánea. Relacionada con esta observación, Mackenzie et al., (1978), en ovinos infectados con T. congolense demostraron la presencia de material antigénico derivado de los tripanosomas sobre los glóbulos rojos, por lo que sugieren que la fagocitosis de los eritrocitos en órganos del sistema retículo endotelial, tiene una importancia significativa en el desarrollo y mantenimiento del estado anémico. Similannente, Taiwo y Anosa (2000), en bovinos infectados con T. vivax y T. congolense, indican un rol de factores estimuladores de macrófagos in vivo, especialmente citoquinas como THF-alfa y IFN-gamma, así como antígenos de parásitos, los cuales pueden actuar en el proceso de destrucción aumentada de eritrocitos por el sistema fagocítico mono nuclear. Por otra parte, se ha sugerido que los tripanosomas producen un factor hemolítico que contribuye a la lisis de eritrocitos (Igbokwe, 1994). Otras causas propuestas para el origen de la anemia son: efecto traumático directo de los tripanosomas sobre las células rojas, incremento de la fragilidad osmótica de los eritrocitos por efecto de la fiebre, autoanticuerpos a eritrocitos (Assoku y Gardiner, 1989; ILRAD, 1990), adhesión de antígenos del tripanosoma o complejos antígeno anticuerpo a la superficie del eritrocito (Williams et al., 1992) y dishemopoyesis (Suliman y Feldman, 1989). En este estudio se presentó un descenso significativo (P<0,05) en el número de p1aquetas que coincidió con la aparición del primer pico de parasitemia y alcanzó niveles trombocitopénicos individuales tan bajos como 95x103 plaq/mm3 el día 9 PI.
Fue evidente una relación inversa entre los niveles de plaquetas y la parasitemia de los animales infectados, especialmente durante la fase aguda de la infección (Figura 4). Esta asociación estuvo caracterizada por caídas en el número de plaquetas que se presentaron en el momento o inmediatamente después de un pico de parasitemia, mientras que cuando los tripanosomas no fueron detectados o fueron escasos, los niveles de plaquetas usualmente se incrementaron. Esta característica de la infección sugiere que la disminución de estas células está relacionada a la magnitud de la parasitemia. Correspondiendo con el criterio anterior, se ha involucrado un efecto tóxico directo de los tripanosomas o de sus productos (enzima proteica o toxina) sobre las plaquetas, que es corroborado por la capacidad de los mismos o el sobrenadante de los tripanosomas rotos, de ocasionar agregación plaquetaria in vitro, lo que ocasionaría la trombocitopenia (Anosa et al., 1992).
Otra causa propuesta es el daño inmunológico mediado por la formación de complejos inmunes entre el T. vivax y anticuerpo s específicos, con daño a las plaquetas por adherencia inmune, componentes del complemento o por substancias farmacológicamente activas tales como las cininas (Davis et al., 1974, Slots et al., 1977). Lo expuesto explicaría la disminución de las plaquetas cuando hay gran cantidad de tripanosomas vivos en sangre y durante las crisis tripanolíticas donde se liberan sustancias que pueden ocasionar agregación plaquetaria o la formación de complejos inmunes, mientras que cuando disminuyen los tripanosomas en sangre, hay una recuperación en el número de plaquetas. Durante la fase subaguda hubo tendencia a la recuperación en el número de plaquetas. Estas observaciones sugieren que los mecanismos involucrados en las alteraciones en el número de plaquetas que ocurren en la tripanosomiasis animal, pueden estar relacionados con la dinámica de la infección. CONCLUSIONES El aislado de T. vivax utilizado en este estudio produjo una infección que cursó clínicamente con dos fases:
SUMMARY Trypanosoma vivax is the etiological agent of a kind of trypanosomiasis in ruminants, which is the most pathogenic and geographically distributed. The present work intented primarily to study the effect of experimental infection with a Venezuelan iso late of T. vivax on the parasitological, clinical and hematological parameters of 15 male, mixedrace (West African x Persian Black Head) sheep. Among these animals, 10 sheep were randomly selected to form an infected group, and five animals were used as uninfected controls. The experimental infection consisted ofthe intravenous injection of 2 ml of blood contained 1.3xl06 Tryp/ml. Over a 57 -day period, the following variables were evaluated: temperature, parasitaemia, clinical signs, body weight, haematocrit (Ht), haemoglobin (Hb), and platelets count. In this period oftime the infected animals showed an ondulating parasitaemia an two phases ofthe disease: an acute y sub-acute phase. The predominant clinical symtoms observed were: remittent fever, paleness of the mucous membranes, depression, poor aspect of the skin, testicular inflammation, progressive thinning, nasal and ocular sero-mucosal secretion, and respiratory difficulty. During the acute phase of the disease an accelerated reduction occurred in the mean values ofthe Ht, Hb and platelet count. The sub-acute phase was characterised by the maintenance ofthe mean Ht and Hb values at a low level and a tendency to recuperate or to increase the numbers of platelets. This study provides important elements which allow a characterization of the pathogenic behavior of isolates of T. vivax in Venezuela. Key Words: Trypanosoma vivax; trypanosomiasis; sheep; hemathology. BIBLIOGRAFÍA ANOSA, V. O., L. L. LOGAN-HENFREY and M. K. SHAW. 1992. A light and electron microscopic study of changes in blood and bone marrow in acute hemorrhagic Trypanosoma vivax infection in calves. Vet. Pathol. 29:33-35. ASSOKU, R. K. G andP. R. GARDINER. 1989. Detectionofantibodies to platelets and erythrocytes during infections with haemorrhage-causing Trypanosoma vivax in Ayrshire cattle. Vet. Parasitol. 31:199-216. DÁ VILA, A. M. and R. A. SILVA. 2000. Animal trypanosomiasis in South America. Current status, partnership, and information technology. Ann N Y Acad Sci. 916:199-212. DAVIS, C. E., R. S. ROBBINS, R. D. WELLER and A. J. BRAUDE. 1974. Trombocytopenia in experimental trypanosomiasis. J. C1in. Invest. 53: 1.359-1.367. ESPINOZA, E. 1988. Evaluación clínica, parasitológica y serológica de bovinos infectados experimentalmente con Trypanosoma vivax. Trabajo de Grado de Maestría. Maracay, Ven. Universidad Central de Venezuela. Facultad de Ciencias Veterinarias. Postgrado de Medicina Veterinaria. 221 p. ESPINOZA, E. y E. TORTOLERO. 1990. Un método simple de conservación de Trypanosoma vivax para su uso en infecciones experimentales. In: Giardina, S. y García, F. (Ed.). Hemoparásitos: Biología y Diagnóstico. Caracas, Venezuela. pp. 147-167. ESPINOZA, E., E. SANDOVAL, M. MAVARE, N. GONZALEZ y L. RANGEL. 2000. Comparación de la serie eritrocítica y 1eucocítica en ovejas y cabras infectadas con Trypanosoma vivax. Veterinaria Trop. 25(1):29-39. GARCÍA, F. A., C. SUÁREZ, E. DAZA, D. SIMOES y M. RIVERA. 2002. Brotes causados por Trypanosoma vivax en rebaños de caprinos y ovinos del estado Falcón, Venezuela. In: XXVII Jornadas Científicas y VI Internacionales de la Sociedad Española de Ovinotecnia y Caprinotecnia (SEOC). Valencia. 19-21/09. España: 599-604. GAUDENS, L. G. de F. 1984. Manual de hemostasia y coagulación sanguínea. Universidad Central de Venezuela. Ediciones de la Biblioteca. Caracas. 495 p. HOARE, C. 1972. The Trypanosomes of Mammals. The Salivaria. Blackwell Scientific publication, Oxford. 401-429 p. IGBOKWE, I. O. 1994. Mechanisms of cellular injury in african trypanosomiasis. Vet. Bull. 64(7):611-620. ILRAD. 1990. Why do 1ivestock infected with trypanosomes develop anaemia? International Laboratory for Research on Animal Diseases. 8(3-4):1-6. KATUNGUKA-RWAKISHAYA, E., M. MURRAY and P. HOLMES. 1992. The pathophysiology of ovine trypanosomosis: haematological and blood biochemical changes. Vet. Parasit. 45:17-32. LUMSDEN, W. H., J. HERBERT and J. C. Mc NEILLEGE. 1973. Techniques with Trypanosomes. Churchill Livinstone. MACKENZIE, R. K., W. P. BOYT, V. W. NESHAM and E. PIRUE. 1978. The aetiology and significance ofthe phagocytosis of erythrocytes and leukocytes in sheep infected with Trypanosoma congolense (Broden, 1904). Res. Vet. Sci. 24:4-7. MAVARE, M. 1996. Efecto de la infección experimental de Trypanosoma vivax sobre parámetros clínicos, hematológicos y niveles de progesterona en cabras. Trabajo de Grado de Maestría. Maracay, Ven. Universidad Central de Venezuela. Facultad de Ciencias Veterinarias. 101 p. MEYER, D. J. y J. W. HARVEY. 2000. El laboratorio en medicina veterinaria. interpretación y diagnóstico. 2nd ed. Edición. Inter-Médica. Buenos Aires. Argentina. 397 p. OSAER, S., B. GOOSSENS, S. KORA and I. JEFFCOATE. 1999. Effects of Trypanosoma congolense infection and diet on puberty, age at first 1ambing and haematology changes in Djallonké ewe lambs. Vet. Parasit. 80:215-230. ROA N, C. FUENMAYOR, R. ORDOÑEZ, L. SOLER, A. RIVAS, R. TAMASAUKAS, H. RUIZ, M. COBO y A. AGUIRRE. 1998. Relación entre la prevalencia del Trypanosoma vivax y la respuesta reproductiva en hembras gestantes en un rebaño cerrado de ovinos en Aragua, Venezuela. In: I Simposium Nacional Hemoparásitos y sus Vectores. Maracay. 1-2/10. Venezuela: 64 p. SANDOVAL, E. 1994. Variaciones fisiopatológicas de la anemia en ovejas infectadas experimentalmente con Trypanosoma vivax. Trabajo de Grado de Maestría. Maracay, Ven. Universidad Central de Venezuela. Facultad de Ciencias Veterinarias. Postgrado en Medicina Veterinaria. 131 p. SHAW, J and R. LAINSON. 1972. Trypanosoma vivax in Brasil. Annals Trop. Med. Parasit. 66(1):25-32. SLOTS, J. M., A. S. VAN MIERT, J. W. AKKERMAN and A. L. DE GEE. 1977. Trypanosoma brucei and Trypanosoma vivax: antigenantibody complexes as a cause of platelet serotonin release in vitro and in vivo. Exp. Parasit. 43: 211-219. STEPHEN, L. S. 1986. Trypanosoma (Duttonella) vivax. Ziemann, 1905. Chapter 2. In: Trypanosomiasis a Veterinary Perspective. 19-68 p. SULIMAN, H. B. and B. F. FELDMAN. 1989. Pathogenesis and aetiology of anaemia in trypanosomiasis with special reference to T. brucei and T. evansi. Vet. Bull. 59(2):99-107. TAIWO, V. O. and V. O. ANOSA. 2000. In vitro erythrophagocytosis by cultured macrophages stimuled with extraneous substances and those isolated from the blood, spleen and bone marrow of Boran and N'Dama cattle infected with Trypanosoma congolense and Trypanosoma vivax. Onderstepoort J. Vet. Res. 67(4):273-287. TAMASAUKAS, R., N. ROA, P. M. ASO, H. RUIZ, A. AGUIRRE, L. SOLER Y R. ORDÓÑEZ. 1998. Diagnóstico por QBC e IFI de Trypanosoma vivax en ovinos estabulados en un rebaño cerrado del estado Aragua, Venezuela. In: I Simposium Nacional Hemoparásitos y sus Vectores. Maracay. Venezuela: 66 p. WAISWA, C. and E. KATUNGUKA-RWAKISHAYA. 2004. Bovine trypanosomiasis in south-western Uganda: packed-cell volumes and prevalences of infection in the cattle. Annals Trop. Med. Parasit 98(1):21-27. WILLIAMS, D. J., L. L. LOGAN-HENFREY, E. AUTHIÉ, C. SEELY and F. CODIMBA. 1992. Experimental Infection with a HemorrageCausing Trypanosoma vivax in N'Dama and Boran cattle. Scand. J. Immunol. 36 (Suppl. 11):34-36. WOO, P. T. K. 1969. The haematocrit centrifuge for the detection of trypanosomes in blood. Canadian Journal of Zoology. 47(5):921-923. |