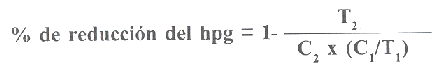|
Veterinaria Trop. 26(2):147-158. 2001 DROGAS ANTIHELMÍNTICAS SOBRE ESTRÓNGILOS DIGESTIVOS EN OVINOS ESTABULADOS Gustavo Morales* y Luz A. Pino* *Investigadores. INIA.
Recibido: julio 01, 2002. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
RESUMEN Con el fin de evaluar la eficacia de los antihelmínticos Albendazol® y Doramectina® se escogieron 27 ovinos de un total de 67 ovejas de la raza Barbados de barriga negra los cuales fueron examinados coproparasitológicamente por medio de la técnica de McMaster con solución salina sobresaturada como líquido de flotación. Los animales seleccionados fueron divididos en tres grupos de nueve integrantes cada uno: a) tratados con Albendazol®, b) tratados con Doramectina®, c) no tratados. Para balancear los tres grupos y así poder realizar el ensayo con lotes de animales que presentarán cargas parasitarias equivalentes, se distribuyeron equitativamente y al azar los animales con cargas bajas, moderadas y altas en cada uno de los tres grupos. Siete días después del tratamiento todos los animales fueron examinados nuevamente con la técnica de McMaster. Los dos grupos tratados mostraron diferencias en los recuentos de hpg cop. respecto al grupo control. Sin embargo, el grupo tratado con Albendazol® resultó con un porcentaje de reducción del 32,7%, indicativo de la existencia de un alto nivel de resistencia a esta droga. Mientras que el grupo tratado con Doramectina® presentó una reducción del 100%, lo cual puede explicarse porque este producto estaba siendo usado por primera vez en el plantel. La resistencia al Albendazol® en animales estabulados, sugiere que las larvas de nematodos resistentes fueron introducidas con el pasto de corte. Palabras Clave: Resistencia antihelmíntica; ovinos; estróngilos digestivos; condiciones de estabulación; Albendazol®; Doramectina®. INTRODUCCIÓN En ovinos criados en condiciones naturales el poliparasitismo o infección pluriespecífica es la regla (Morales, 1989) y su principal método de control es mediante el empleo de antihelmínticos de amplio espectro de acción (Waller, 1997), cuyo uso es indiscriminado y casi exclusivo, ya que no es asociado con otras medidas complementarias no químicas, para el control racional de la estrongilosis gastrointestinal, lo cual ha favorecido el desarrollo de resistencia de los estróngilos digestivos frente a diversas drogas antihelmínticas (Gruner, 1985). Esta resistencia a los antihelmínticos ha sido descrita como la habilidad hereditaria de algunos nematodos parásitos para sobrevivir a la acción vermicida de los antihelmínticos a las dosis terapéuticas recomendadas (Taylor y Hunt, 1989). Según Coles y Roush (1992) la resistencia puede desarrollarse en varias especies de nematodos hacia un tipo de antihelmíntico (resistencia multiespecífica) o en una especie de nematodo hacia varios tipos de dicha droga (resistencia múltiple). Los genotipos de parásitos capaces de resistir a la acción de los antihelmínticos, están probablemente presentes, en menor cuantía en cualquier población (Lejambre, 2000), pero la presión de selección ejercida por una alta frecuencia de tratamiento favorece el incremento de individuos resistentes al interior de una población originariamente sensible al quimioterápico (Taylor y Hunt, 1989). El fenómeno de la resistencia a los antihelmínticos ha sido ampliamente reseñada en estróngilos digestivos de ovinos, caprinos y equinos, destacándose por su alta implicación los compuestos pertenecientes al grupo de los benzimidazoles (Urquhart et al., 1999), aunque en la actualidad son cada vez más frecuentes los soportes de resistencia a las lactonas macrocíclicas (Waller, 1997; Taylor y Hunt, 1989). El propósito del trabajo fue evaluar la posibilidad de existencia de resistencia antihelmíntica en un rebaño ovino de raza Barbados barriga negra (BBN), de la isla de Trinidad (Trinidad y Tobago), criado en condiciones de estabulación y alimentado con pasto de corte, ante dos drogas reconocidas por su amplio espectro de acción: Albendazol (Vermicide®) y Doramectina (Dectomax®). MATERIALES Y MÉTODOS Área de muestreo El estudio fue desarrollado en la Estación Experimental "Centeno Livestock Station", perteneciente al Ministerio de Agricultura, Tierra y Recursos Marinos de la República de Trinidad y Tobago. El clima en la zona de estudio es tropical y la temperatura promedio diaria de 29°C. La pluviometría tiene una distribución bimodal con dos estaciones: estación seca, desde enero hasta mayo y estación lluviosa: desde junio a diciembre. La vegetación está compuesta de Acacia margium, Digitaria spp., Pennisetum purpureum y Brachiaria erecta. El rebaño de la estación está compuesto por ovinos puros de la raza BBN y por mestizos predominantemente BBN X West African. Los ovinos eran mantenidos permanentemente en estabulación y alimentados con pasto de corte proveniente de un potrero utilizado por otros rumiantes, principalmente ovinos, los cuales venían siendo tratados con benzimidazoles, en los dos últimos años. Métodos Parasitológicos Se empleó la técnica coproscópica de McMaster con solución de NaC1 sobresaturada como líquido de flotación (Morales y Pino, 1977). Esta técnica se aplicó tanto para la selección de los animales a participar en el ensayo como para la conformación de los lotes experimentales, así como para el establecimiento del porcentaje de reducción de los huevos de estróngilos digestivos en la materia fecal (FECRT), luego de la administración de los antihelmínticos. Para evitar errores en la interpretación de los resultados debidos a la suspensión temporal de la oviposición por acción del quimioterápico o incrementos de dicha oviposición debidos a la reinfección parasitaria, las coproscopías cuantitativas evaluativas no deben realizarse ni antes de los 7 días ni después de los 10 d postratamiento (Honer y Bianchin, 1989), en este caso dicha evaluación se realizó a los 7 d postratamiendo (Hansen y Perry, 1994). Dosificación Antihelmíntica Los animales seleccionados para el ensayo fueron pesados individualmente para garantizar que recibieran la dosis exacta de acuerdo a su peso corporal. La dosificación exacta de Albendazol® (vía oral) en función del peso corporal, se garantizó mediante el empleo de jeringas descartables (Nari et al., 2000). Para la evaluación de la resistencia antihelmíntica se siguió el protocolo de la prueba de FECRT propuesto por Nari et al. (2000) con algunas adaptaciones a las condiciones particulares del ensayo. Antes de comenzar la aplicación del protocolo, se suspendieron los tratamientos antihelmínticos del rebaño, con la finalidad de garantizar que al iniciarse el ensayo, los animales tuvieran 10 semanas sin recibir ninguna dosificación antihelmíntica. La toma de muestra de heces se hizo directamente del recto de cada animal. Para la evaluación coprosparasitológica previa al inicio del ensayo y para la selección de los animales a utilizar en la prueba se estableció como requisito, el uso de ovinos cuya carga parasitaria expresada en huevos por gramo de heces (hpg) fuera igualo superior a 150 hpg de acuerdo a lo recomendado por McKenna (1985). En vista de que tan solo 27 animales cumplieron con dicho requisito, se conformaron tres lotes (uno control y dos de tratamiento) de 9 animales cada uno. Cada grupo fue identificado a nivel de la oreja mediante etiquetas de diferentes colores. Considerando las cargas parasitarias de los animales, se procedió a ubicar al interior de cada lote, el mismo número de integrantes con cargas similares, de manera de obtener la mayor homogeneidad posible, en cuanto al criterio a evaluar, es decir el porcentaje de FECRT. Finalmente, para evitar un posible "efecto raza" se trabajó únicamente con animales puros de la raza BBN o con alto mestizaje de dicha raza, sin embargo, el posible efecto edad no fue considerado en vista de que la diferencia en la excreción de hpg entre ovinos jóvenes y adultos no es consistente (Maciel et al., 1996), constituyendo el recuento de los hpg el criterio más idóneo para la conformación de los lotes experimentales.
Análisis de los datos Previo a la dosificación antihelmíntica se realizó una comparación a los recuentos de los hpg de cada uno de los ovinos del ensayo y agrupados en sus lotes respectivos, mediante el análisis de varianza de KruskalWallis (Morales y Pino, 1995), con la finalidad de determinar si los valores de hpg en los tres grupos eran similares y por consiguiente, se podía proceder a la evaluación de la eficacia de los antihelmínticos. Porcentaje de reducción del recuento de hpg Para la evaluación de la eficacia de los antihelmínticos Albendazol® y Doramectina® se utilizó el porcentaje de reducción del hpg usando al grupo control como factor de corrección (Edwards et al., 1986). Para establecer dicho porcentaje los recuentos de hpg fueron transformados logarítmicamente (Gill et al., 1986) y con estos datos se calculó la media geométrica del recuento de hpg, tanto en el pre-tratamiento, como a los siete días post-tratamiento, luego dichos valores fueron utilizados en la siguiente fórmula:
En la cual: T1 = Recuento del hpg pre-tratamiento del grupo tratado (log hpg + 10) T2 = Recuento del hpg post-tratamiento del grupo tratado (log hpg + 10) C1 = Recuento del hpg pre-tratamiento del grupo control (log hpg + 10) C2 = Recuento del hpg post-tratamiento del grupo control (log hpg + 10) Interpretación: Un resultado se considera indicativo de resistencia si la reducción de la media geométrica del hpg en el grupo tratado es menor del 95% y si el límite inferior del intervalo de confianza de dicho porcentaje de reducción a un nivel a = 5% es menor del 90%. El considerar ambos criterios permite emitir un diagnóstico de resistencia con seguridad (Nari et al., 2000). RESULTADOS Y DISCUSIÓN La no existencia de diferencias estadísticamente significativa entre los recuentos de hpg de los tres lotes experimentales, indican la adecuada conformación de los mismos y por consiguiente, la pertinencia de usarlos para evaluar la eficacia de los antihelmínticos, (Cuadro 1). La eficacia del albendazol® expresada en porcentaje de reducción de los hpg fue de sólo 32,7%, muy por debajo del 90% y 95%, valores establecidos como límites para diagnosticar resistencia, lo cual indica el alto grado de resistencia al antihelmíntico, presente en los estróngilos digestivos de los ovinos utilizados en el ensayo.
Por el contrario, en el caso de la Doramectina®, la eficacia fue del 100%, indicativo de que las poblaciones de los nematodos mencionados son susceptibles a la acción de esta droga (Cuadro 2). En zonas tropicales, los productores aumentan la frecuencia en el uso de antihelmínticos durante la época de lluvias, debido a que el incremento de los niveles pluviométricos constituye uno de los factores de mayor importancia en el desarrollo y sobrevivencia de las fases exógenas y endógenas de los parásitos (Hansen y Perry, 1994). Debido a que el parasitismo gastrointestinal es uno de los factores limitantes de la producción ovina en el trópico (Fabiyi, 1987), el incremento de la productividad en las explotaciones de rumiantes a través del control de sus helmintos parásitos depende, entre otros factores de la disponibilidad de antihelmínticos eficaces y de bajo costo. Por lo tanto, la aparición de cepas de parásitos quimioresistentes desprovee al productor de uno de sus medios de lucha contra las estrongilosis digestivas de sus rebaños (Hansen y Perry, 1994). La resistencia a los antihelmínticos ha sido señalada en la mayoría de los países del mundo (Waller, 1997), afectando a especies parásitas presentes en hospedadores tales como ovinos, caprinos, bovinos, equinos y cerdos (Prichard, 1994).
En el caso específico de los estróngilos digestivos de los ovinos han sido involucradas las lactonas macrocíclicas, como la Doramectina® y benzimidazoles como el Febendazol® (Mwamachi et al., 1995), así como el Levamisol® y el Thiabendazol (Edwards et al., 1986). En el presente caso, de los dos antihelmínticos evaluados, et albendazol® mostró baja eficacia, indicativa de la resistencia de poblaciones de estróngilos digestivos resistentes a su acción, lo cual es cada vez más frecuente a nivel mundial con los benzimidazoles (Waller, 1997; Prichard, 1994). La resistencia al Albendazol® en los estróngilos digestivos presentes en los ovinos de este ensayo, puede ser debida a que dichas ovejas, aunque eran mantenidas en estabulación permanente, eran alimentadas con pasto de corte, procedente de potreros pastoreados por otros ovinos, los cuales eran sometidos a tratamientos antihelmínticos frecuentes con este quimioterápico desde hacía aproximadamente dos años. Por lo tanto, puede considerarse que se trata de una resistencia introducida conjuntamente con el pasto de corte. En efecto, Coles y Roush (1992) señalan que poblaciones de nematodos resistentes pueden ser introducidos a un rebaño mediante la incorporación de animales procedentes de otros rebaños. Los resultados del presente trabajo sugieren que el pasto fresco cortado es también una buena vía para la diseminación de la helmintoresistencia e implica la importancia de prevenir la introducción de cepas de parásitos quimioresistentes en la explotación, mediante la estricta aplicación de medidas de cuarentena y diagnóstico de resistencia antihelmínticas, previo a la incorporación de los animales a los pastizales (Lejambre et al., 2000) y de las larvas recuperadas del pasto por pruebas in vitro como el Drenchrite (Csiro, 1996). En el caso de la Doramectina®, es importante resaltar, que es un producto de reciente introducción en la isla y por su elevado costo es muy poco utilizado por los granjeros. Sin embargo, es de esperarse la aparición de resistencia a este antihelmíntico, ya que en otros países, es bien conocido que su forma inyectable es considerada la presentación más eficaz comparada con la oral para estimular el desarrollo de resistencia dada su mayor persistencia en el organismo (Maciel et al., 1996), ya que al estar controlada por un gen único completamente dominante en estado larvario y ligado al sexo en estado adulto (más manifiesto en hembras) conlleva a que este tipo de resistencia se desarrolle más rápidamente que la resistencia a los benzimidazoles, que es de tipo poligénica (Lejambre et al., 2000) y vinculada a la alta frecuencia de los tratamientos (Gruner, 1985). Los trabajos de resistencia a las lactonas macrocíclicas dentro de las cuales esta incluida la Doramectina® son cada vez más frecuentes (Craig y Miller, 1990; Mwamachi et al., 1995; Maciel et al., 1996). Es importante destacar que este tipo de evaluación es conveniente realizarlo con grupos iguales de 10 a 15 animales por grupo, para garantizar la mayor confiabilidad posible de los resultados (Honer y Bianchin, 1989), sin embargo, en este trabajo se evaluaron 9 animales por grupo debido a un criterio de selección de los animales basados en el recuento de hpg para la conformación de los lotes, garantizando que los mismos presentaran similares niveles de infección como criterio primordial para darle confiabilidad a los resultados. En caso de requerirse información acerca de los géneros parasitarios involucrados en la resistencia antihelmíntica, es recomendable la realización de coprocultivos en pool por grupo el día cero y el día de la evaluación post-tratamiento con la finalidad de la identificación de los géneros parasitarios presentes a través de sus larvas infectantes (L3; Fiel et al., 2002), pero con fines prácticos y considerando que la mayor parte de los antihelmínticos en el mercado son de amplio espectro, la detección de la resistencia basados en la prueba de reducción en el recuento de hpg, es suficiente para tomar las medidas pertinentes y hacer las recomendaciones adecuadas al productor (Coles y Roush, 1992). SUMMARY With the purpose of evaluating the effect of Albendazole® and Doramectin® on gastrointestinal nematode parasites of sheep reared under pen conditions, twenty seven sheep were selected from a 67 Barbados Black Belly flock on the basis of fecal parasite egg counts (FEC) by McMaster method performed before treatment. Sheep were ranked in descending order on the basis of fecal parasite egg counts. The first three sheep on the list were randomly allocated to one of three groups. The procedure was repeated with subsequent sets of three sheep until all animals had be en allocated to three groups of 9 animal s each. After allocation, a color coded eartag, identifying the treatrnent group assignment was applied. Seven days after treatment all animals were examined again and the individual FEC was ca1culated. Both Albendazole® and Doramectin® groups resulted in differences with respect to the control group. However, the percentage reduction of Albendazole® was 32,7%, indicating a high level of resistance against this drug, while in Doramectin® group the reduction was 100%, the high level of Albendazole® resistance in sheep reared under pen conditions suggest that strongylid resistant L3 larvae, were introduced with cut grass coming from a paddock grazed by other sheep, frequently drenched with Albendazole®. Key Words: Anthelmintic resistance; sheep; digestive strongyles; pen condition; Albendazole®; Doramectin®. BIBLIOGRAFÍA COLES, G. and R. ROUSH. 1992g. Slowing the spread of anthelmintic resistance nematodes of sheep and goats in the United Kingdom. The Veterinary Record; 130: 505-510. CRAIG, T. and D. MILLER. 1990. Resistance by Haemonchus contortus to ivermectin in Angora goats. Veterinary Record. 126:580. CSIRO. 1996. Drench Rite. A larval development assay for the detection of anthelmintic resistance. Csiro Research, Australia. 29 pp. EDWARDS, J., R. WROTH, G. CHANNET, R. BESIER, J. KARLSON, P. MORCOMBE, G. DALTON-MORGAN and D. ROBERT. 1986. Survey of anthelmintic resistance in Western Auntralian sheep flocks. 1. Prevalence. Australian Veterinary Joumal; 63: 135-138. FABIYI, J. 1987. Production losses and control ofhelminthes in ruminants of Tropical regions. Intemational Journal for Parasitology; 17:435-442. FIEL, C., O. ANZIANI, V. SUÁREZ, R. VÁZQUEZ, C. HEDÍ, J. ROMERO, J. CARACOSTANGOLO. C. SAUMELL, M. MEJÍA, J. ACOSTA and P. STEFFANI. 2002. Resistencia antihelmíntica en bovinos: causas, diagnóstico y profilaxis. Vet. Arg. 171 :21-33. GILL, J. L., G. ERICSSON and I. HELLAND. 1986. Precision of assessing anthelmintic efficacy. Biometrics. 42:981-987. GRUNER, L. 1985. Control des strongyloses digestives des petits ruminants aux Antilles Francaises: development de resistance aux benzimidazoles et intéret d'une gestion raisonnee de paturages. Revue d'elevage et Medicine Veterinaire Des Pays Tropicaux. 38: 386.393. HANSEN, J. and B. PERRY. 1994. The epidemiology. Diagnosis and control of helminth parasites of ruminants. F.A.O. ILRAD. Nairobi, Kenya. 171 pp. HONER, M. and I. BIANCHIN. 1989. Teste para quantificar a resistencia de nematódeas cóntra productos anti-helminticos. EMBRAPA. Brasil. 5 pp. (Comunicación Técnica No. 32). LEJAMBRE, L., J. GILL, J. LENANE and P. BAKER. 2000. Inheritance of ivermectin resistance in Haemonchus contortus. Intern. J. Parasitol. 30: 105-111. MACIEL, S., A. JIMÉNEZ, C. GAONA, P. WALLER and J. HANSEN. 1996. The prevalence of antihelmintic resístance in nematode parasites of sheep in Southern Latin America: Paraguay. Veterinary Parasitology. 62:207-212. McKENNA, P. 1998. Diagnosis of gastrointestinal nematodes parasitism in goats. Foundation for Continuing Education of New Zealand Veterinary Association. Proceeding ofa Curse in Goat Husbandry and Medicine. p. 86-95. MORALES, G. 1989. Epidemiología y sinecología de los helmintos parásitos de ovinos y caprinos de zonas áridas del Estado Lara; Venezuela Rev. Fac. Cs. Vet. U.C.V. 38:9-52. MORALES, G. y L. A. PINO. 1977. Manual de diagnóstico helmintológico en rumiantes. Edit. Colegio de Médicos Veterinarios del Estado Aragua, Maracay, Venezuela. 100 pp. MORALES, G. y L. A. PINO. 1995. Parasitometría. Ediciones Universidad de Carabobo, Valencia, Venezuela. 224 pp. MWAMACHI, D., J. AUDIO, W. TORPE and R. BAKER. 1995. Evidence for multiple anthelmintic resistance in sheep and goats reared under the same management in coastal Kenya. Veterinary Parasitology. 54:259-268. NARI, A., J. HANSEN, C. EDDI, F. ECHEVARRIA, E. MACIEL, C. CARACOSTANGOLO, J. SALLES y CH. CUTULLE. 2000. Protocolo de trabajo para la evaluación a campo de cepas potencialmente resistentes a los antihelmínticos. Prueba de reducción del recuento de huevos en materia fecal (FECRT). www.inia.gov.ar/producto/helminto/ protdiag.htm. 4 pp. PRICHARD, R. 1994. Anthelmintic resistance. Veterinary Parasitology. 54: 259-268. TAYLOR, M. and K. HUNT. 1998. Anthelmintic drug resistance in the U. K. The Veterinary Record. 125:143-147. URQUHART, 0., J. ARMOR, J. DUNCAN, A. DUNN and F. JENNINGS. 1999. Veterinary Parasitology. Second Edition; Black Well Science, Reino Unido. 307 pp. WALLER, P. 1997. Anthelmintic Resistance. Veterinary Parasitology. 72:391-412. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||