|
Veterinaria Tropical 21(1): 13-33.
1996
Trypanosoma vivax Espartaco Sandoval*, E. Espinoza** y A. Valle*** *
FONAIAP
Estación
Experimental Falcón
Coro, estado Falcón |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
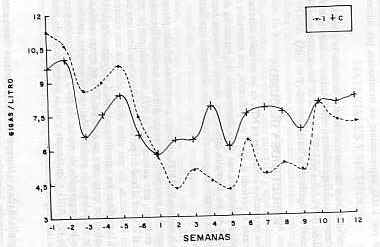
RESUMEN Con el objeto de conocer la fisiopatología de la anemia que un aislado venezolano de T. vivax provoca en pequeños rumiantes, nueve ovejas mestizas West-african de 2 años de edad y 25,9 ± 3 kg promedio de peso se seleccionaron con el uso de la tabla de números aleatorios. Los seis primeros lugares correspondieron a animales que fueron inoculados por vía intravenosa, con 1,0 ml de sangre conteniendo aproximadamente 3,106 Parásitos, provenientes de un caprino positivo; las tres ovejas restantes fueron consideradas controles. Las variables; parasitemia, leucocitos y trombocitos, fueron evaluadas durante 120 días. El comportamiento clínico de la enfermedad reflejó una fase aguda, una subaguda y una crónica. Leucopenia moderada, debido a neutropenia y eosinopenia acompañada de linfocitosis y monocitosis fue observada en las fases aguda y subaguda, además de un cuadro trombocitopénico correlacionado con la aparición del parásito en sangre. La complejidad del cuadro patológico obtenido, sugiere la continuidad de estos estudios y su validación en condiciones naturales. Palabras Clave: Trypanosoma vivax; anemia; ovejas. INTRODUCCIÓN El considerable impacto económico que la tripanosomiasis animal provoca, tanto directa como indirectamente, sobre las ganaderías de los países tropicales y subtropicales de África y América ha motivado numerosos estudios (WILSON et al., 1986) que han permitido definirla como una enfermedad parasitaria extensiva y debilitante de tendencia crónica, caracterizada clínicamente por caquexia, anemia y muerte del animal (ESPINOZA, 1988; IKEDE, 1975; VOHRADSKY, 1969). Las infecciones por tripanosomas se caracterizan por una leucopenia inicial asociada con neutropenia, linfopenia, eosinopenia y monocitos (ANOSA, 1988). La mayoría de los estudios describen en los rumiantes infectados con T. vivax una leucopenia inicial, casi siempre en las tres primeras semanas después de la infección, recuperándose posteriormente los valores de los leucocitos hasta cerca de los niveles de preinfección. Igualmente se asocia a la leucopenia con los períodos de alta parasitemia (ANOSA, 1988; ANOSA y ISOUN, 1980; ESPINOZA, 1988; IGBOUKWE y ANOSA, 1989). En la infección con tripanosomas existen varios mecanismos por los cuales pueden verse afectados los leucocitos, directa o indirectamente, predisponiéndolos a la destrucción por fagocitos del sistema fagociticomononuclear (SMF). Los tripanosomas también pueden alterar los tejidos del hospedador, lo cual resulta en un funcionamiento patológico, como en el caso de la pérdida de la funcionalidad de las células precursoras de la médula ósea (ANOSA, 1988; KAAYA et al., 1979; KATUNKA et al., 1992), mientras que, los efectos sobre los órganos linfoides inducen a la linfopenia, proliferación de células plasmáticas y excesiva producción de inmunoglobulinas, algunas de las cuales son autoanticuerpos que actúan directamente contra las células del hospedador (ANOSA, 1988). El suero de bovinos infectados con T. vivax deprime la formación de macrófagosgranulocitos in vitro y se ha especulado que un factor sérico pueda tener efecto sobre los leucocitos circulantes (IGBOKWE y ANOSA, 1989; KAAYA et al., 1979). No obstante, no hay información sobre el papel de un factor plasmático in vivo en la patogénesis de la leucopenia (IGBOKWE y ANOSA, 1989). La neutropenia se ha descrito en infecciones de ovinos y bovinos con T. vivax (ANOSA, 1988; ESEIVO y SAROR, 1983), sin embargo, ESPINOZA (1988) no encontró cambios significativos en bovinos Holstein infectados experimentalmente con T. vivax. De la misma manera, se presenta linfopenia en ratones, ovinos y bovinos infectados con T. vivax. ESPINOZA (1988), respecto al número de linfocitos, observó que el estado de leucopenia inicial coincidió con disminución drástica de los mismos e igualmente sus datos fueron similares a los obtenidos por ANOSA e ISOUN (1980) en ovejas y cabras infectadas con este parásito. MURRAY y DEXTER (1988) e IGBOKWE y ANOSA (1989) expresan que la leucopenia se debe a una disminución de los linfocitos y neutrófilos. La linfopenia puede aumentar por la depleción de los linfocitos en los ganglios linfáticos, y por secuestro en las reacciones inflamatorias producidas en las infecciones con T. vivax en los diferentes rumiantes. La monocitosis es un hallazgo consistente en las tripanosomiasis, siendo señalada en infecciones de ratones, ovejas y bovinos con T. vivax. Por su parte ESPINOZA (1988) encontró episodios de monocitosis en una infección experimental con T. vivax. durante los 61 días del ensayo. No obstante, ESIEVO y SAROR (1983), en bovinos infectados, no encontraron monocitosis. La literatura señala que la eosinopenia parece ser un carácter patognomónico en las infecciones con tripanosomas (ANOSA, 1983); sin embargo, ESPINOZA (1988) plantea que es difícil clasificar la presencia de la eosinopenia en las tripanosomiasis, ya que el contaje de los leucocitos en los rumiantes normales puede no revelar eosinófilos (COLES; 1986). La trombocitopenia se observa en infecciones con tripanosomas, tanto en humanos como en animales (ANOSA, 1983; GARDINER y WILSON, 1987; ROBINS et al., 1975; WELLDE et al., 1989; 1983; 1978). Usualmente, la trombocitopenia se relaciona con el desarrollo del primer pico de parasitemia o cuando aumentan los tripanosomas en sangre circulante durante las diferentes ondas de parasitemias; es decir, su desarrollo está dramáticamente influenciado por el grado de parasitemia (ANOSA, 1983; DAVIS, 1982; WELLDE et al., 1983; 1978). En consecuencia, se establece una relación inversa entre los parásitos y los niveles de trombocitos (ANOSA, 1983; WELLDE et al., 1989). Adicionalmente, es importante acotar la relación de la trombocitopenia con la coagulación intravascular diseminada (CID), ya que existe el criterio de que los tripanosomas o sustancias asociadas con ellos producen agregación plaquetaria y por ende se reduce la vida media de los trombocitos (ANOSA, 1983; GARDINER, 1989; WELLDE et al., 1989). La adhesión masiva interplaquetaria estimula los procoagulantes, los cuales podrían promover la coagulación intravascular (FELDMAN, 1988). WELLDE et al., (1989), observaron el desarrollo de una marcada trombocitopenia en infecciones con T. vivax, asociada con tiempos prolongados de protrombina, elevados niveles de fibrinógeno y productos de degradación del fibrinógeno (PDF). ESPINOZA (1988), al interpretar los datos de los trombocitos en su ensayo, verificó un cuadro de trombocitopenia, el cual se pudo asociar mediante estudios histopatológicos con los hallazgos de coagulación intravascular diseminada en los diferentes órganos. MATERIALES Y MÉTODOS Se utilizaron nueve ovejas hembras mestizas de la raza West-African de dos años de edad y un peso promedio de 25,9 ± 3 kg. Mediante el uso de la tabla de número aleatorios (CENTRO PANAMERICANO DE ZOONOSIS, 1973) se asignaron los seis primeros lugares a los animales inoculados y los tres restantes a los animales controles. Ambos grupos fueron aislados en locales separados. La alimentación consistió en heno, pasto picado, alimento concentrado, sales minerales y agua ad libitum. Un ml de sangre fresca proveniente de un caprino positivo, detectado por la técnica de WOO (1969) conteniendo aproximadamente 3 x 106 Trypanosoma vivax fue inyectado a las ovejas del estudio. El caprino había sido inoculado previamente con un estabilizado de T. vivax en dimetil sulfóxido, criopreservado en nitrógeno líquido a -196 °C. La dosis total de inoculación fue estimada por medio de un hemocitómetro con el empleo de solución fisiológica en una dilución (1:10), según la metodología de PARRA y VIZCAINO (1979). El seguimiento de la infección por T. vivax se hizo a través de la obtención de muestras de sangre de la vena yugular con EDTA como anticoagulante; cada tres días durante las primeras ocho semanas de postinfección y luego semanalmente en las 4 semanas restantes. La técnica aplicada para la determinación de la parasitemia comprendió el procedimiento de la microcentrifugación (WQQ, 1969). El número total de leucocitos (NTL) se efectuó mediante el uso del hemocitómetro (cámara de Neubauer), utilizando solución de Turk; la suma total se multiplicó por el factor 50 expresándose los resultados en gigas por litros (G/l = 109). El recuento diferencial de leucocitos se efectuó en frotis sanguíneos teñidos con Giemsa al 10% y leídos a través de la técnica denominada "guarda griega", contando 100 leucocitos (SCHALM et al., 1981). La determinación de los trombocitos se realizó mediante el uso del hemocitómetro y la técnica del tubo (LYNCH et al., 1985). Como líquido diluyente se empleó una solución de oxalato de amonio al 1% con un añadido de azul cresil brillante a una concentración del 0,25%. La suma total se multiplicó por 1.000, expresándose en trombocitos por microlitros (trob / % l). Los valores obtenidos fueron comparados mediante la prueba "t" de student para muestras independientes, efectuándose además análisis de correlación lineal de Pearson entre los valores de las variables estudiadas. Se utilizó un nivel de significación máximo de 5% (P < 0,05). RESULTADOS Y DISCUSIÓN Los cambios promedios semanales en NTL de los animales infectados y controles, durante el período de pre y postinfección, son mostrados en la Figura 1, donde se evidencia una clara disminución del promedio de los leucocitos totales en los animales infectados, desde la primera hasta la novena semana del período de postinfección, con diferencias significativas (P<0,05).
A partir de la semana 9, el NTL aumentó por encima del valor promedio de las ovejas controles, para posteriormente ubicarse a un nivel ligeramente más bajo. Sin embargo, este aumento en el NTL mostrado por las ovejas infectadas con el T. vivax al final del período de infección indican una cierta elevación de los leucocitos, sin que estos niveles alcancen sus valores de preinfección, ni la media de los animales controles. La disminución del NTL en la fase postinfección representó un nivel del 57% en comparación a las estimaciones de los valores de preinfección; con diferencias estadísticas significativas en la comparación de medias de pre y postinfección para el grupo infectado (P < 0,01) e igualmente para la comparación de medias totales entre los dos grupos de animales. En la bibliografía se cita a la leucopenia como un síntoma clínico común en humanos y animales infectados con tripanosomas, situación que en términos generales, no varía para el caso de rumiantes infectados con T. vivax (ANOSA e ISOUN, 1980; IGBOKWE y ANOSA, 1989). LOSOS (1986) fue del criterio que la leucopenia se presenta en concordancia con la primera onda de parasitemia y luego los leucocitos retornan a los niveles de preinfección o cercanos a ellos. La determinación del NTL mostró un comportamiento parecido a lo señalado en la bibliografía, en tal sentido, con la presencia del primer pico de parasitemia (Cuadro 1) se desarrolló en las ovejas inoculadas una disminución en el NTL. No se pudo afirmar la presencia de una verdadera leucopenia, porque los valores de las ovejas infectadas con el T. vivax fluctuaron dentro de los rangos presentados como normales para la especie (COLES, 1986; DOXEY, 1987; IGBOKWE y ANOSA, 1989).
ESPINOZA (1988) y ESPINOZA y ASO (1991) identificaron una leucopenia en bovinos Bos taurus, infectados con un estabilizado similar de T. vivax, descenso que fue simultáneo con la primera ola de parasitemia. Posteriormente, los valores del NTL tendieron a la recuperación y fluctuaron dentro de los rangos mostrados como normales por diversos investigadores. El comportamiento del NTL de las ovejas infectadas marcó una pauta general, la disminución de sus promedios semanales desde la primera onda de parásitos diagnosticados en sangre, manteniéndose hasta cerca del final del lapso de observación en el cual, los niveles totales de los leucocitos se elevaron a cifras superiores a las determinaciones de preinfección y de la media grupal de los animales controles, pero, esos bajos niveles obtenidos siempre estuvieron dentro del límite inferior fisiológicamente como normal para la especie (COLES, 1986; DOXEY, 1987). Por consiguiente, las variaciones del NTL de las ovejas retadas con el T. vivax en el presente trabajo, no fueron diferentes con las presentadas por IGBOKWE y ANOSA (1989) quienes informaron el desarrollo de una disminución moderada de los leucocitos en ovejas infectadas con T. vivax. En ese orden de ideas, encontramos un antagonismo con los resultados de KATUNGUKA et al. (1922) quienes obtuvieron un marcado aumento del NTL en ovejas infectadas experimentalmente con T. congolense, atribuyéndolos principalmente a un aumento de los linfocitos. A diferencia de la investigación anterior, MACKENZIE et al. (1978) expresan el desarrollo de una leucopenia como consecuencia de una leucofagocitosis, motivado a la formación de un complejo antígeno tripanosomal-leucocitos. Otros autores (ESEIVO y SAROR, 1983; KATUNGUKA et al., 1992) imputan el desarrollo de la leucopenia a daños en la membrana de los leucocitos, seguido a la producción de neurominidasa o a una depresión de la producción de leucocitos en la médula ósea. KATUNGUKA et al. (1922) plantean la posibilidad de que una elevada respuesta leucocitaria en animales afectados por tripanosomas sea generalmente concordante con un buen pronóstico y la proliferación de los linfocitos pueda estar asociada con la habilidad de las razas en particular , para mantener una efectiva respuesta inmunológica que límite la intensidad de la parasitemia (GARDINER, 1989; MURRAY y DEXTER, 1988). En referencia a los bovinos, se encuentran resultados divergentes. ESPINOZA (1988), ESPINOZA y ASO (1991) y ESPINOZA et al., (1991) determinaron un período inicial leucopénico, alternándose con períodos de recuperación de los leucocitos situación que contrastó con los resultados de la presente investigación, a pesar de haber trabajado con igual cepa de T. vivax. ESIEVO y SAROR (1983) y ANOSA et al. (1992) afirmaron que la leucopenia es seguida por una leucocitosis. De tal manera que la mayoría de los autores concuerdan sobre la presencia temprana de una leucopenia en rumiantes infectados con tripanosomas. En relación con los neutrófilos se observa (Cuadro 2) cambios con diferencias significativas (P < 0,05) para la fase de infección, al comparar las medias semanales del grupo de las ovejas infectadas y controles (semanas 2, 3, 4, 5, 6, 9 y 10). Esta disminución del nivel promedio de los neutrófilos obtenido durante el período de postinfección representa un 30%, cuando se contrastó ese valor con la media de los neutrófilos del período de preinfección, con diferencias significativas (P < 0,01) .
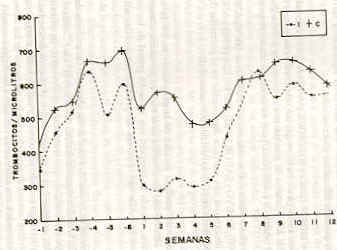
En lo que respecta a la estimación absoluta de los linfocitos, se aprecia un aumento gradual de estas cédulas en las ovejas inoculadas a partir de la sexta semana del lapso de observación (1 semana de infección), manteniéndose esta tendencia hasta el final del experimento con ligeras oscilaciones, las cuales correspondieron a las semanas 2 y 6 de la fase posterior a la exposición con el T. vivax. La contrastación de las medias totales para ambos grupos (infectados y controles), revela un aumento sostenido de los linfocitos en los animales enfermos durante la fase de postinfección (P < 0,01 ), así como para la comparación de las medias de pre y postinfección con el grupo inoculado (P<0,01). El valor promedio absoluto de los linfocitos observados en las ovejas controles durante las 18 semanas del ensayo fue muy semejante a los señalados para la especie en la literatura. El recuento de los monocitos indicó una estimación mayor de estas células en los animales infectados a partir de la primera semana después de haber sido retados con el T. vivax, con diferencias significativas al compararse con los controles (semanas 1,2,3,4,5,6,7,8,10 y 12) (P<0,01). Las determinaciones de los monocitos en las ovejas infectadas, a partir de la primera semana de infección mostraron un cuadro de monocitosis el cual fue de carácter sostenido hasta el final del ensayo. La comparación de las medias de estas células en la segunda semana de infección evidenció los valores más altos obtenidos durante el experimento para las ovejas enfermas. También se obtuvo Una diferencia significativa (P < 0,01) entre las medias del grupo infectado antes y después de la inoculación, así como en la comparación de medias totales entre grupos. Con relación a los eosinófilos, el Cuadro 1 revela las variaciones semanales ocurridas en la determinación de los valores de leucocitos. En tal sentido, se pudo observar una disminución significativa (P<0,0l) en la media total (pre y postinfección) de las ovejas infectadas y las que sirvieron como controles. Con respecto al comportamiento de estos elementos en la serie blanca, el presente trabajo evidenció principalmente la participación de los neutrófilos en el establecimiento de la posible leucopenia o en la disminución del NTL en las ovejas infectadas. Al respecto existen ciertas divergencias entre los investigadores, ANOSA e ISOUN (1980) verificaron que los linfocitos y los monocitos no participaron con el desarrollo en la fase inicial de la leucopenia, mientras que IGBOKWE y ANOSA (1989) observaron una disminución de los linfocitos y eosinófilos, lo cual contribuye a la presencia de la leucopenia en las etapas iniciales de las tripanosomiasis. ESIEVO y SAROR (1983) señalan la participación de los neutrófilos; ESPINOZA (1988) la de los linfocitos y ANOSA et al. (1992) la de los linfocitos y neutrófilos. En cuanto al contaje diferencial de los leucocitos (Cuadro 2) se observó en los neutrófilos de las ovejas infectadas experimentalmente valores alternos que no mostraron cambios significativos en comparación con los valores promedios normales señalados para los ovinos (COLES, 1986, DOXEY, 1987). Estadísticamente se pudo establecer diferencias significativas en los promedios semanales durante todo el experimento. No obstante, de la interpretación y contrastación de las determinaciones de los niveles de neutrófilos en las ovejas infectadas y las sanas, se infiere que en las ovejas enfermas con el T. vivax, no presentaron alteraciones patológicas en la serie de los neutrófilos. ANOSA e ISOUN (1980) detectaron neutropenia en ovejas y cabras durante la fase aguda de la enfermedad y la atribuyeron probablemente a una depresión parcial de la médula ósea de los animales infectados. IGBOWE (1989) no identificó mayores variaciones al referirse a los neutrófilos. Por otro lado, ESIEVO y SAROR (1983) indicaron el hallazgo persistente de la disminución de los neutrófilos en becerros infectados con T. vivax, situación diferente a lo observado por ESPINOZA (1988), en novillas infectadas con T. vivax. ANOSA et al. (1992) con una cepa hemorrágica de T. vivax, encontraron neutropenia durante el lapso de su estudio experimental. Para el caso de los linfocitos el curso fue diferente, apreciándose un aumento gradual en la serie a partir de la primera semana de patencia del T. vivax en los animales infectados, manteniéndose la tendencia hasta el final del experimento, aunque los niveles oscilaron dentro de los rangos (0,25 a 0,75 1/1) considerados como normales en la literatura (JAIN, 1986), Situación contraria a los datos obtenidos por IGBOKWE y ANOSA (1989) quienes evidenciaron linfopenia en las ovejas infectadas. KATUNGUKA et al. (1992) informaron sobre la presencia de una linfocitosis en las ovejas retadas con T. congolense. Para el caso de bovinos, ESPINOZA (1988) y ESPINOZA et al. (1992) señalaron linfopenia en los primeros días de la parasitemia (T. vivax) concomitantemente con la detección de altos picos del hemoparásito. ANOSA et al. (1992) informaron que al inicio de la parasitosis se presenta una linfopenia y en la fase crónica de la infección una linfocitosis. En esta investigación la serie monocítica mostró claramente un patrón de monocitosis a partir del período de postinfección, siendo más evidente desde la primera semana de la fase de infección, aspecto que se mantuvo sin mayor diferencia hasta el final del experimento. En tal sentido, los resultados concordaron con lo expuesto por ANOSA e ISOUN (1980); ANOSA (1988); IGBOKWE y ANOSA (1989); EMERIBE y ANOSA (1991) quienes encontraron como un hallazgo consistente en las tripanosomiasis una elevación de los monocitos, conjuntamente con una marcada proliferación de macrófagos en los tejidos. Dentro del mismo orden de ideas, están los trabajos de ESPINOZA (1988); ESPINOZA y ASO (1991) y ESPINOZA et al. (1992) quienes encontraron una monocitosis en sus experimentos. Es de particular importancia lo expuesto por JAIN (1986) en referencia a que los parásitos intracelulares y las anemias hemolíticas producen una reactividad hiperplásica del sistema fagocítico mononuclear (SFM), con manifestaciones clínicas de aumento en el tamaño del hígado y bazo. Quizás a través de este fenómeno fisiopatológico se pueda explicar el cuadro de monocitosis mostrado en las ovejas infectadas con el T. vivax, además de poder asociarlo en conjunto con el carácter más común de las tripanosomiasis, como es el síndrome de anemia hemolítica. Los eosinófilos no indican mayor información para interpretar cualquier alteración fisiopatológica en los mismo. Sin embargo, la comparación de las medias grupales generales mostró una diferencia significativa entre los valores de los animales infectados y los controles. ANOSA e ISOUN (1980) y IGBOKWE y ANOSA (1989) refrendan el hallazgo de una eosinopenia en las ovejas infectas con T. vivax, con la única diferencia que los primeros le asocian con neutropenia y los segundos expresan que ocurrió la eosinopenia, pero sin asociarse con neutropenia. Respecto a los bovinos y otros rumiantes, TOURE et al. (1978); ANOSA e ISOUN (1980); ESIEVO y SAROR (1983); ESPINOZA (1988) y ANOSA et al. (1992) observaron una marcada disminución en el promedio de los eosinófilos, difiriendo en la causal del cuadro eosinopénico. Con el inicio del período patente de la parasitemia en los animales infectados se observó una disminución en el número promedio semanal de los trombocitos, cuando se comparó con la media grupal de las ovejas controles y con la media del período de preinfección de ellas mismas (Figura 2). La disminución de la cantidad total de las plaquetas fue evidente desde la séptima hasta la decimosegunda semana del ensayo ( 1a a la 5ta semana del período de postinfección), presentándose diferencias significativas (P<0,01) en las semanas 2,3,4, a pesar de que el número de trombocitos fluctuó dentro del rango considerado como normal por la literatura. A partir de la decimotercera semana de postinfección las plaquetas de los animales inoculados se elevaron hasta niveles muy cercanos a las ovejas controles. No hubo diferencias significativas en la comparación de medias en los períodos de pre y postinfección para el grupo inoculado, pero sí en la comparación de medias totales entre este grupo y el control (P<0,01). Además , en la fase aguda de la infección se observa una relación inversa entre los niveles del T. vivax y los valores de trombocitos, aspecto corroborado a través del estudio del coeficiente de correlación (r = -0,3680).
A pesar de la evidente disminución de las
plaquetas en las ovejas infectadas y ser estadísticamente
significativo (P < 0,05), el valor promedio de estos animales fue de
282 x 103 trom /µ La trombocitopenia se ha presentado en humanos con tripanosomiasis naturalmente adquiridas; los agentes en estos casos fueron el T. rhodesiense y T. congolense (WELLDE et al., 1989; 1983; 1978). De igual manera se cita como un hallazgo común en los animales domésticos de Africa (DA VIS, 1982; DIRIE, 1988; GARDINER y WILSON, 1987). WELLDE et al. (1989; 1983; 1978) detectaron una disminución en el número de trombocitos (trombocitopenia), con una relación inversa entre los niveles de trombocitos y la parasitemia. Hallazgos similares en la disminución de las plaquetas circulantes señaló DAVIS (1982) al estudiar infecciones con tripanosomas en animales domésticos y salvajes, siendo la magnitud de la disminución independiente de la ruta de administración del parásito, del género o raza de ganado y la especie de tripanosoma; adicionalmente indició la presencia de diferencias estadísticamente significativas entre la severidad de la trombocitopenia y las altas parasitemias. Para explicar la trombocitopenia, WELLDE et al. (1978) indicaron un efecto inicial del parásito o sus productos sobre las células precursoras (megacariocitos) o sobre los trombocitos en si mismo. En el mismo orden de ideas, DA VIS (1982) sugirió que la trombocitopenia probablemente es causada por uno o más mecanismos de agregación plaquetaria durante el curso de la tripanosomiasis. WELLDE et al. (1982; 1978), ANOSA y KANEKO (1983) y ANOSA et al. (1992) observaron que la destrucción de trombocitos está acompañada por un aumento de su síntesis. Investigaciones conducidas por VALLI et al. (1978) en bovinos infectados con T. congolense sugieren que la recuperación de los trombocitos es consecuencia de un incremento de la masa de megacariocitos. En el presente trabajo la disminución de los niveles de trombocitos está en el orden del 49% existiendo una correlación positiva con la parasitemia producida por este aislado venezolano de T. vivax. El descenso de los niveles de trombocitos fueron similares a los señalados por otros autores estudiando variantes africanas (ANOSA et al., 1992; ANOSA y KANEKO, 1983; WELLDE et al., 1983; 1978). Vale acotar además que esta misma cepa, cuando se inoculó en bovinos Bos taurus, desarrolló trombocitopenia (ESPINOZA et al., 1992; ESPINOZA , 1988). La coagulación intravascular diseminada (CID) es un desorden fisiopatológico, en el cual una trombosis intravascular difusa causa defectos hemostáticos, debido a la reducción de los factores de coagulación y de las plaquetas como un resultado de su utilización en los procesos trombóticos y la propiedad anticoagulante de los productos de degradación del fibrinógeno generadores de la activación del sistema fibrinolítico, la cual ha sido asociado en los animales domésticos con diversas patologías orgánicas o funcionales de la estructura corporal (JAIN, 1986; WELLDE et al., 1989). DAVIS (1982) fue del criterio que la relación entre la CID y la trombocitopenia no es lo suficientemente clara. Diversos estudios han mostrado evidencias bioquímicas o patológicas de la coagulación intravascular en humanos y animales (ROBINS et al., 1975; WELLDE et al., 1978). Algunos autores han sugerido que esas anormalidades se deben a autoanticuerpos contra el fibrinógeno o los propios trombocitos (ASSOKU et al., 1989; RICKMAN y COX, 1980; 1979). Resulta interesante resaltar que la cepa de T. vivax venezolana estudiada por ESPINOZA (1988) y ESPINOZA et al. (1992) generó microtrombos en diferentes órganos de los bovinos afectados por el tripanosoma, situación que se evidenció a través de los estudios histopatológicos. No se pudo demostrar tal alteración microscópica en las ovejas infectadas (datos no publicados). SUMMARY Phisiopatology of the anemia that a Venezuelan isolated of T. vivax produces on small ruminants was estimated on 9 randomly assigned crossbred west-African ewes, that averaged 2 year old and 50.2± 6 lb of body weight. The first six ewes were intravenously inoculated with 1,0 ml of blood containing approximately 3.106 parasites from a positive goat; the other 3 were used as a control group. Parasitaemia, leukocyte and thrombocyte were evaluated during 120 days. Clinical performance of sicknees showed an acute, a subacute and a cronic phases. Moderate leucopenia observed on the acute and subacute phases was associat a to a neutropenia and eosinopenia with lynpbocitosis and monocytosis, in addition to a thrombocytopenia withb presence of parasite in the blood. Complexity of pathological signs suggest continuity of this study and a real enviroment valition Key Words: Trypanosoma vivax; anemia; ewes. BIBLIOGRAFÍA ANOSA, V., L. LOGAN, M. SHAW .1992. A Light and Electro Microscopic Study of Changes in Blood and Bone Marrow in Acute Haemorrhagic Tripanosoma vjvax Infection in Calves. Veterinary Pathology. 29: 33-45. ANOSA, V. O. 1988. Haematological and biochemical changes in human and animal Trypanosomiasis. Part I Revue D'Elevaje et De Medicine Veterinaire des Pays Tropicaux (1): 65- 78. ANOSA, V. O. 1988. Haematological and biochemical changes in human and animal Trypanosomiasis. Part II. Revue D'Elevaje et De Medicine Veterinare des Pays Tropicaux 41(2): 151-164. ANOSA V .O. and J. J. KANEKO. 1983. Pathogenesis of Trypanosoma brucei infections in Deer Mice (Peromyscus maniculatus): Hematologic, Erythrocyte, Biochemical and Iron Metabolic Aspects. American Journal Veterinary Research. 44(4): 639-644. ANOSA V. O. and T. T. ISOUN. 1980. Haematological studies in Trypanosoma vivax Infection of goats and intact splenectomized sheep. Journal Comparative Pathology. 90: 155-168. ASSOKU, R. K. and P. R. GARDINER. 1989. Detection of Antibodies to platelets and erythrocytes during infection with haemorrage caused by Trypanosoma vivax in Ayrshire Cattle. Veterinary Parasitology. 31 (3-4): 199-216. CENTRO PANAMERICANO DE ZOONOSIS. 1973. Procedimientos para estudios de prevalencia de enfermedades crónicas en el ganado. Ramos Mejías. (Buenos Aires), Argentina. Organización Panamericana de la Salud. (Nota Técnica No.18). pp. 32-35. COLES, L.1986. Veterinary Clinical Pathology. (4a ed.) Saunders. Philadelphia. pp. 10.72. DAVIS, C. E. 1982. Thrombocytopenia: A Uniform complication in African Tripanosomiasis. Acta Trópica 39: 123-133. DIRIE, M. P., K. R. WALLBANS, D. H. MOLYNEUX, S. BORNSTEIN and H. A. OMER. 1988. Haemorrhagic Syndrome Associated whit Trypanosoma vivax infections of cattle in Somalia. Acta Trópica 54(2): 291-292. DOXEY, D. 1987. Patología clínica y procedimientos de diagnóstico en Veterinaria. (2a ed.) Manual moderno. México. pp. 187-202. EMERIBE, A. and V. ANOSA. 1991. Haematology of Experimental Trypanosoma brucei gambiense Infections. II Erythrocyte and Leucocyte Changes. Revue D'Elevaje et des Medicine Veterinaire de Pays Tropicaux 44(1): 53-57. ESIEVO, K. A. N. and D. I. SAROR. 1983. Leukocyte Response in experimental Trypanosoma vivax infection in cattle. Journal Comparative Pathology 93: 165-169. ESPINOZA, E., P. ASO and I. CAMACARO. 1992. Haematologic Values of Infected Bovine with a Venezuelan Isolate of Trypanosoma vivax First International Seminar on Non- TseTse Transmitted Animal Trupanosomoses. pp. 130. (Resumen). ESPINOZA, E., P. ASO and I. CAMACARO.1991. Valores hematológicos de bovinos infectados experimentalmente con un aislado venezolano de Trypanosoma vivax. Parte I Eritrocitos. Revista de Salud Animal. (En prensa). ESPINOZA, E. y P. ASO. 1991. Valores hematológicos de bovinos infectados experimentalmente con un aislado venezolano de Trypanosoma vivax. Parte II Leucocitos. Revista de Salud Animal. (En Prensa). ESPINOZA, E. 1988. Evaluación clínica parasitológica y serológica de bovinos infectados experimentalmente con Trypanosoma vivax Trabajo presentado para optar al título Magister Scientiarium Postgrado Medicina Veterinaria. Universidad Central. Maracay, Venezuela. FELDMAN, B. 1988. New Approaches in Treatment of Dic. American Animal Hospital Association 55: 101-102. GARDINER, P. R. 1989. Recent Studies of the Biology of Trypanosoma vivax Advances in Parasitology 28: 229-317. GARDINER, P. R., A. J. WIL.SON. 1987. Trypanosoma (Duttonella) vivax. Parasitology Today 3(2): 49-52. IGBOKWE, I. 1989. Dyserythropoiesis in Animal Trypanosomosis. Revue D'elevaje et de Medicine Veterinaire Des Pays Tropicaux 42(3): 423-429. IGBOKWE, I. O., and V.O. ANOSA. 1989. Leucopenia in Trypanosoma vivax Infection of Sheep. Revue D'Elevage de Medicine Veterinary Des Pays Tropicaux 49(2): 219-221. IKEDE, B.O. and O. J. LOSOS. 1975. Pathogenesis of Trypanosoma brucei Infection in Sheep. Journal Comparative Pathology 85: 23-31. JAIN, N. 1986. Veterinary Hematology Schalm's (4a ed.). Lea y Febiger: Philadelphia. pp 208-224. KAAYA, G. P., V. E. D. VALLI, M. G. MAXIE and G. J. LOSOS.1979. Inhibition of Bovine Bone Marrow Granulocyte macrophage Colony Formation in vitro by Serum Collected from Cattle Infected with Trypanosoma vivax or Trypanosoma congolense. Tropenmedizen and Parasitologie 30: 230-235. KATUNGUKA, E., M. MURRAY and P. HOLMES.1992. Pathophysiology of Ovine Trypanosomiasis: Ferrokinetics and Erythrocyte Survival Studies. Research in Veterinary Science 53: 80-86. KATUNGUKA, E., M. MURRAY and P. HOLMES. 1992. The Pathophysiology of Ovine Trypanosomiasis: Haematological and Blood Biochemical Changes. Veterinary Parasitology 45: 17-32. LOSOS, G.. 1986. Infections Tropical Diseases oí Domestic Animals. Canadá, Longman. pp.182-318. LYNCH, M. S. RAPHAEL, L. MELLOR, P. SPARE y M. INWOOD.1985. Métodos de Laboratorio (2º ed.). Interamericana. México. pp. 703- 766. MACKENZIE, P. K. I., W. P. BOYT , V. W. NESHAM and E. PIERE. 1978. The Aetiology and Significance of the Phagocytosis of Erythrocites and Leucocytes in Sheep Infected with Trypanosoma congolense (Broden, 1904). Research in Veterinary Science 24: 4- 7. MURRUAY, M. and T. M. DEXTER. 1988. Anemia in Bovine African Trypanosomiasis. Acta Trópica. 45: 389-432. PARRA, G. y O. VIZCAINO. 1979. Manual de técnicas de laboratorio del programa de parasitología y entomología veterinaria. (Bogotá). Instituto Colombiano Agropecuario. División de Ciencias Veterinarias. 150-152. RICKMAN, W. J. and H. W. COX. 1980. Immunologic Reactions Associated with Anemia, Thrombocytopenia, and Coagulopathy in Experimental African Trypanosomiasis. Journal Parasitology 66(1): 28-33. RICKMAN, W. J. and H. W. COX.1979. Association of Autoantibodies with Anemia, Splenomegaly, and Glomerulonephritis in Experimental African Trypanosomiasis. Journal Parasitology 65(1): 65-73. ROBINS-BROWNE, R. M., J. SCHNEIDER and J. METZ. 1975. Thrombocytopenia in Trypanosomiasis. The American Journal of Tropical Medicine and Hygiene 24(2): 226-231. SCHALM, O., N. JAIN y E. CARROLL. 1981. Hematología veterinaria. (1a Ed.) Hemisferio Sur. Buenos Aires (Arg.). 857 p. TOURE, S., A. GUEYE, S. MAMADOU and A. MANE. 1978. Experience de Phatologie Comparee entre Bovins et N'dama Soumes a L'infection Naturelle par Des Trypanosomes Pathogenes. Revue D'elevage de Medicine Veterinaire Des Pays Tropicaux 31(3): 292-313. VALLI, O. M. FORSBERG and J. McSHERR Y. 1978. The Patogenesis of Trypanosoma congolense Infection in Calves. II. Anaemia and Erythroid Response. Veterinary Pathology 15: 732-745. VOHRADSKY, P. F. 1969. Clinica1 Signs, Daily Rate of infection, Physica1 Changes of the Blood and Pathomorphologica1 Changes in Cattle Artificially Infected by Trypanosoma vivax. Revue D'elevaje et De Medicine Veterinaire des Pays Tropicaux 24: 257-263. WELLDE, B. T ., M. J. REARSEON, F. ONYANGO, D. A. CHUMO, R. M. MURIITHI and L. M. ROBERTS. 1989. Natural and Acquired Resistance to Trypanosoma vivax in Cattle, Annals of Tropical Medicine and Parasitology 83(1): 185-194. WELLDE, B.T., D. A. CHUMO, M. ADOYO, R. M. KORVATHC, G. N. MOWGELA and E. A. OPIYO. 1983. Haemorrahagic syndrome in Cattle Associated with Trypanosoma vivax Infection. Tropical Animal health Production 15: 95-102. WELLDE, B. T ., R. M. KOVATCH, D. A. CHUMO and D. E. WYKOFP . 1978. Trypanosoma congolense Thrombocytpenia in Experintentally Infected Cattle. Experimental Parasitology 45: 26-33. WILSON, A. J., G. M. GOTUTA, A. R. NJOGU and S. P. MGUTU.1986. Alushula. A Simple Epidemiological Method for Animal Trypanosomiasis to Provide Relevant Data for Effective Financial Decision Making. Veterinary Parasitology 20: 261-274 WOO, P. 1969. The Haematocrit Centrifuge for the Detection of Trypanosomas in Blood. Canadian Journal of Zoology 47(5): 921-923. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||