|
Veterinaria Tropical. 15: 3-16. 1990
VACUNA
BIVALENTE INACTIVADA CONTRA LA BABESIOSIS BOVINA: M.
Toro Benítez*,B. Montenegro-James**, E. León Arenas*, A. López Boyer*, 1Investigaciones
del Convenio FONAIAP-Universidad de lllinois. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
RESUMEN Con el fin de determinar la eficacia, duración de inmunidad y estabilidad de una vacuna combinada bivalente de B. bovis/B. bigemina, se realizaron ensayos en bovinos mestizos y/o puros altamente susceptibles. Los exoantígenos combinados se suministraron, por vía subcutánea, en dos dosis con cuatro semanas de intervalo y se utilizaron como indicadores esenciales de la inmunidad inducida los siguientes parámetros fisio-patológicos: nivel y duración de parasitemia, máxima reducción porcentual del hematocrito y ganancia de peso corporal después del desafío. Los animales vacunados mostraron un buen grado de protección frente al desafío con parásitos virulentos de B. bovis y B. bigemina, cepas venezolanas. Por otra parte, el inmunógeno combinado fue capaz de inducir protección por un período relativamente largo (hasta 14 meses) frente al desafío secuencial con parásitos heterólogos. Además, la vacuna liofilizada mostró un adecuado grado de estabilidad (3 1/2 años) en condiciones de refrigeración. Los resultados indicaron reactividad serológica cruzada entre B. bovis y B. bigemina; sin embargo, su correlación con una protección cruzada significativa no ha sido definitivamente probada. En consecuencia, el uso de una vacuna combinada bivalente de B. bovis/B. bigemina para la inmunoprevención de la babesiosis bovina parece ser lo más indicado hasta la fecha. INTRODUCCIÓN La babesiosis bovina, enfermedad hemotrópica causada por protozoarios de las especies Babesia bovis y B. bigemina (Smith y Kilbourne, 1893), constituye uno de los principales obstáculos en el desarrollo de la industria ganadera de países tropicales y sub-tropicales (4), en los cuales, la política de mejoramiento de la ganadería nativa ha ocasionado una creciente demanda de razas exóticas de mayor productividad (10). Los bovinos importados de zonas libres son altamente susceptibles, siendo afectados en forma severa al ser introducidos en áreas endémicas, con alta morbilidad y mortalidad (2). Por otra parte, la enfermedad también es común en bovinos nacidos en áreas enzoóticas como resultado de deficientes prácticas de manejo o inapropiadas medidas de control. Las pérdidas causadas por la babesiosis se atribuyen principalmente a deficiente ganancia de peso, reducción de la producción láctea, costo en fármacos, atención veterinaria y mortalidad. En América Latina, las pérdidas ocasionadas por las enfermedades hemotrópicas en bovinos se estiman en más de 800 millones de dólares anuales (8). En Venezuela, estudios seroepidemiológicos recientes han demostrado una alta prevalecía de la babesiosis bovina, con cifras superiores al 80% para B. bovis y de 85% para B. bigemina, en algunas regiones del país (14). El control de la babesiosis mediante el uso de drogas quimioprofilácticas y quimioterapéuticas constituye un método oneroso, difícil y poco práctico (15). Actualmente, sólo se dispone de vacunas vivas en algunos países del mundo (1, 3, 11,16). Sin embargo, su uso puede acarrear serios inconvenientes (9). Así, el desarrollo de vacunas inactivadas, eficientes y seguras para prevenir la babesiosis, sigue siendo aún una necesidad de ámbito mundial y, en este sentido, el desarrollo de métodos de cultivo in vitro de B. bovis (7) y B. bigemina (21) ha permitido la producción de inmunógenos que, en experiencias previas, han resultado eficientes para la inmunoprotección de bovinos frente a ambas especies de Babesia (5, 9, 12, 13, 17, 19). En el presente trabajo se informa sobre los resultados de la vacunación de bovinos susceptibles con un inmunógeno bivalente combinado de B. bovis/ B. bigemina, en relación con aspectos tales como: eficiencia y dosis protectiva, duración de inmunidad y estabilidad. MATERIALES Y MÉTODOS Animales experimentales Se utilizaron bovinos susceptibles (negativos a la prueba de inmunofluorescencia indirecta para Babesia) , mestizos nativos o puros importados raza Holstein, entre 12 y 15 meses de edad, los cuales, se mantuvieron en condiciones de estricto aislamiento y se alimentaron con concentrados, sales minerales y agua ad libitum. Adicionalmente. se esplenectomizaron becerros de 3 a 4 semanas de edad para ser utilizados como reactivadores de cepas. Cepas de Babesia Se utilizaron cepas de B. bovis. y B. bigemina, aisladas en diferente1 regiones de Venezuela, las cuales se mantuvieron en forma de "estabilados" criopreservados en nitrógeno líquido y se reactivaron en becerros esplenectomizados al momento de ser requeridas para cultivo, desafío y/o preparación de frotis para la prueba IFA. Elaboración de los inmunógenos Para los cultivos in vitro y la producción de inmunógenos, según técnicas descritas por Levy y Ristic (7) y Vega et al. (21), se recolectó asépticamente sangre infectada de bovinos inoculados individualmente con cada una de las cepas, con promedios entre 1 y 3% de eritrocitos infectados (%El). Los cultivos se iniciaron con un hematocrito del 10% en medio que contenía 60 y 80% de medio 199 suplementado con 40 y 20% de suero bovino normal para B. bovis y B. bigemina, respectivamente. Los cultivos se incubaron a 37°C en una atmósfera de 3% de CO2 en ambiente humidificado. Las parasitemias promedios, obtenidas en un ciclo de cultivo de 72 horas, fueron de 8% para B. bovis y de 3% para B. bigemina. Brevemente, los pasos seguidos en la preparación del inmunógeno combinado fueron los siguientes:
El régimen de vacunación consistió de 2 dosis, pro vía sub-cutánea, con intervalo de 4 semanas entre dosis. Diseño Experimental Experimento 1 (eficiencia y dosis protectiva) Veinte y tres bovinos Holstein puros, de 15 meses de edad, se dividieron en tres grupos de cinco animales cada uno, los cuales se vacunaron con inmunógeno combinado (B. bovis/B. bigemina) en dosis de 10 ml/eq, , 5,0 ml/eq y 1,0 ml/eq para cada una de las especies de Babesia. Ocho animales no vacunados sirvieron como controles. Tres meses después de la segunda dosis vacunal, todos los animales recibieron un reto parasitario de 1 x 109 organismos virulentos de cada especie (cepas homólogas). Los controles no vacunados se desafiaron individualmente, recibiendo igual dosis de desafío (n = 4 para B. bovis y n = 4 para B. bigemina). Experimento 2 (duración de inmunidad) Veinte bovinos Holstein puros, de 15 meses de edad, se dividieron en dos grupos de vacunados (n = 6) y dos grupos de controles sin vacunar (n = 4). Los animales se vacunaron con dosis de 10 ml/eq de sobrenadante de cultivo por cada especie de Babesía y se desafiaron a los 14 meses (n = 6) y 18 meses post-vacunación. Simultáneamente, en cada reto parasitario, se desafiaron los controles sin vacunar (n = 4). El desafío consistió de 1 x 109 organismos virulentos de B. bovís y B. bígemína, cepas heterólogas. Experimento 3 (estabilidad de la vacuna) Doce bovinos mestizos Holstein, de 1 año de edad, se dividieron en grupos de cuatro animales cada uno (n = 4) y se vacunaron con inmunógeno combinado de B. bovis/B. bigemina de lotes con diferentes fechas de elaboración: Grupo I: lote 01/julio 84 (3 años y 6 meses de elaboración); Grupo II: lote 02/octubre 85 (2 años y 3 meses) y Grupo III: lote 08/septiembre 87 (6 meses de elaboración). Cada dosis vacunal consistía de 2,0 ml/eq de exoantígeno de B. bovis y 3,0 ml/eq de B. bigemina, suplementada con 1 ,5 mg de Saponina Ouil-A (dosis utilizada en condiciones de campo). Las vacunas habían sido elaboradas con las cepas B. bovis Yaracuy (lotes l,2) y B. bigemina Zulia (lote 8). Recolección y aná1isis de datos Durante los experimentos, excepto en e13, se determinaron semanalmente los valores de hematocrito, temperatura corporal, peso corporal y presencia y niveles de anticuerpos medidos por la prueba de inmunofluorescencia indirecta (IFA). Post-desafío, además, se determinó la parasitemia (% El) en frotis delgados teñidos por método Giemsa. En el experimento 3 se hizo solamente un seguimiento serológico (prueba IFA) sin desafío de los animales. Los resultados se analizaron y compararon mediante la prueba "t" de significancia estadística. RESULTADOS Experimento 1 En el Cuadro 1 se muestra una comparación de parámetros patológicos esenciales, indicativos de protección, en bovinos vacunados con tres diferentes dosificaciones (10 ml/eq, 5.0 ml/eq, 1,0 ml/eq) del inmunógeno combinado (B. bovis/B. bigemina) y controles. La vacuna bivalente protegió a bovinos altamente susceptibles (Holstein puros) frente al desafío simultáneo con organismos virulentos de B. bovis y B. bigemina, siendo las diferencias significativas (P < 0,05) al comparar los parámetros clínico-fisiopatológicos de los grupos experimentales (vacunados versus controles).
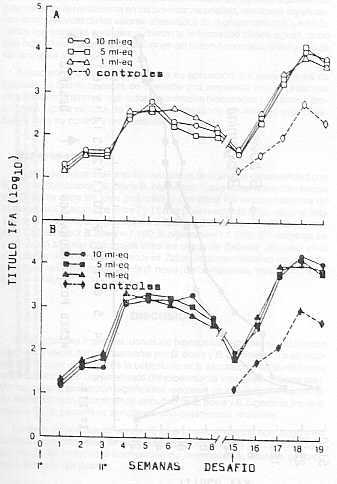
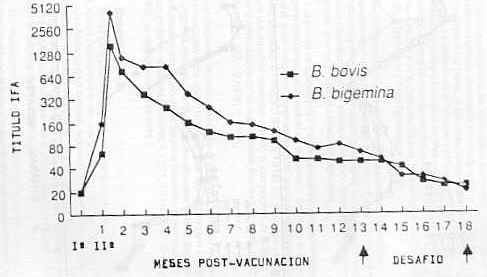
Sin embargo, la respuesta óptima se observó en animales vacunados con dosis de 10 ml/eq, grupo en el cual hubo una reacción fisiopatológica leve y transitoria acompañada de una rápida eliminación de la parasitemia. Al comparar la eficacia observada en este grupo con la de aquellos animales que recibieron 5,0 ml/eq. y 1,0 ml/eq. como dosis vacunal, se constataron diferencias significativas en relación con la duración de parasitemia para B. bigemina (10 ml/eq = 2,5 días; 5,0 ml/eq=5,3días; 1,0 ml/eq=4 días); en la reducción máxima de hematocrito (10 ml/eq=27,7%; 5,0 ml/eq=36,0%; 1,0 ml/eq = 36,0%) y en la ganancia de peso corporal post-desafío (10 ml/eq = 2,5 kg; 5,0 ml/eq = 1,7 kg; 1,0 ml/eq = 1,4 kg). No se observó marcada diferencia en la protección inducida al comparar los grupos vacunados con dosis de 5,0 ml/eq y 1,0 ml/eq. Todos los controles sin vacunar presentaron un cuadro patológico agudo, con manifestaciones clínicas caracterizadas por ataxia, respiración laboriosa, salivación profusa, anorexia, anemia y hemoglobinuria (B. bigemina). Los niveles de anticuerpos IFA en respuesta a la vacunación con el inmunógeno combinado se muestran en la Figura 1. Los títulos post-vacunales para B. bovis resultaron similares en todas las dosis utilizadas (10 ml/eq = 1 :640; 5,0 ml/eq = 1 :480; 1,0 ml/eq = 1 :416). Sin embargo, resultaron más bajos que aquellos obtenidos cuando el inmunógeno de B. bovis se aplicó solo o separadamente en experiencias previas (10 ml/eq = 1 :2560; 5,0 ml/eq = 1 :1 122; 1,0 ml/eq = 1 :501. La respuesta de anticuerpos anti-B. bigemina tampoco mostró diferencias marcadas entre dosis (10 ml/eq = 1 :2432; 5,0 ml/eq = 1 :408; ml/eq = 1 :1 280). No obstante, los títulos post-vacunales para B. bigemina fueron consistentemente superiores a aquellos obtenidos al suministrar el exoantígeno en forma separada (10 ml/eq = 1 :571; 5,0 ml/eq = 1 :501; 1,0 ml/eq = 1 :562), en experiencias anteriores. Experimento 2 En la Figura 2 se observa la cinética de anticuerpos IFA en un período de 18 meses después de la vacunación, en bovinos vacunados con inmunógeno combinado de B. bovis/B. bigemina (10 ml/eq para cada especie) y desafiados en forma secuencia a los 14 y 18 meses post-vacunación. El título máximo promedio de anticuerpos (B. bigemina = 1 :4100; B. bovis= 1 :1 538) ocurrió dos semanas después de la segunda dosis vacunal, descendiendo luego lentamente hasta un nivel básico. El inmunógeno combinado fue capaz de inducir una protección eficiente frente al desafío heterólogo con parásitos virulentos de B. bovis y B. bigemina hasta 14 semanas después de la vacunación.
La reducción porcentual promedio del hematocrito, el porcentaje máximo y duración de la parasitemia en los bovinos vacunados, resultaron significativamente diferentes de los valores observados en el grupo control (Cuadro 2). Todos los animales controles sufrieron la enfermedad clínica aguda, ocho días post-desafío, con manifestaciones del sistema nervioso central y uno de los animales murió. Solamente, 18 meses después de su aplicación, los exoantígenos de Babesia no fueron capaces de sustentar una respuesta inmunoprotectiva efectiva, momento en el cual todos los animales (vacunados y controles) presentaron signos clínicos de la infección, debiendo ser tratados específicamente para su control y recuperación. Experimento 3 En el Cuadro 3 se muestran los resultados de la prueba de estabilidad con la vacuna combinada (B. bovis/B. bigemina). No se observaron diferencias significativas entre los lotes probados al comparar los valores máximos de anticuerpos IFA ocurridos entre 7 y 15 días post-segunda dosis vacunal (lote 1: B. bovis = 1 :320; B. bigemina = 1 :3 620; lote 2: B. bovis= 1 :905; B. bigemina= 1 :2 560; lote 3: B. bovis= 1 :190;B. bigemina= 1 :1 522).Sin embargo,se observaron algunas diferencias entre las cepas de 8abesia utilizadas en la elaboración de la vacuna (Yaracuy vB. Zulia), particularmente en los inmunógenos provenientes del cultivo de B. bovis (títulos máximos: Yaracuy = 1 :905, Zulia=1:190). DISCUSIÓN En condiciones tropicales, donde los bovinos susceptibles son afectados severa y, a veces, simultáneamente por B. bovis y B. bigemina, lo más recomendable para el control de la babesiosis es la vacunación conjunta contra ambas infecciones. Los resultados del experimento 1 mostraron que es posible inducir una protección significativa mediante un inmunógeno combinado, elaborado con exoantígenos de cultivo de B. bovis y B. bigemina, frente al desafío o reto parasitario simultáneo con organismos virulentos. La dosis óptima resultó ser de 10 ml/eq frente al desafío homólogo y los bovinos vacunados eliminaron rápidamente los parásitos presentes en sangre circulante, limitaron la disminución del hematocrito y, además, ganaron peso después del desafío. Títulos mayores y más persistentes de anticuerpos de B. bigemina han sido señalados en sueros inmunes de B. bovis (18). Los resultados obtenidos en muestras experiencia confirma estos hallazgos. por parte, motenegro-James et al. (13) han corroborado, usando una prueba inmunoenzimática de doble anticuerpo (EIA) , la avidez de los anticuerpos de B. bovis frente a antígenos de B. bigemina y Wright et al. (22) demostraron la existencia de reactividad antigénica cruzada usando sistemas homólogos y heterólogos de B. bovis y B. bigemina.
Sin embargo, la sero-reactividad cruzada entre especies de Babesia aún no ha sido definitivamente correlacionada con una inmunoprotección significativa frente a un reto o desafío parasitario y, en tanto no se logre la identificación definitiva de antígenos protectivos comunes inter-específicos, no debe esperarse una protección adecuada mediante el uso de vacunas monoespecíficas. De allí que el uso de una vacuna combinada bivalente parece ser, hasta ahora, lo más racional y adecuado para la inmuno-prevención de la babesiosis bovina. Una característica importante de una vacuna ideal contra la babesiosis es su capacidad para inducir una larga protección Kuttler et al. (6), usando exoantígenos de B. bovis cepa mexicana, suplementados con 1,0 mg de Saponina como adyuvante y suministrados en un régimen de vacunación de dos dosis con tres semanas de intervalo, demostraron que la inmunidad protectiva inducida duraba hasta seis meses frente a un desafío homólogo. Sin embargo, a menudo, se asocia el corto tiempo entre inoculaciones con una declinación rápida de los niveles de anticuerpos y/o un efecto pobre o deficiente de la dosis de refuerzo (17,20). Intervalos de tres a cuatro semanas entre dosis han dado mejores y resultados más consistentes, con persistencia de niveles altos de anticuerpos después de las dos dosis vacunales (5, 12). Los resultados obtenidos en este trabajo reflejaron una inmunoprotección eficiente y duradera (hasta 14 meses) en los animales vacunados, expuestos secuencialmente con parásitos virulentos heterólogos y, en consecuencia, la inmunoprotección permanente de los bovinos podría lograrse mediante un esquema de primo-vacunación y una dosis anual de refuerzo. La vacuna liofilizada además resultó estable en condiciones normales de almacenaje (refrigeración a 4-8°C) y, por lo tanto, se le estimó una vida útil de aproximadamente cinco años. SUMMARY Assays to determine the efficacy, duration of immunity and stability of a combined bivalent B. bovis/B. bigemina vaccine were carried out, in highly susceptible mixed and/or pure bred cattle. Combined exoantigens were given by subcutaneous route in two doses at four weeks intervals and, the protection induced in vaccinated cattle was assesed on the basis of the following essential pathophysiological indicators: level and duration of parasitemia. maximum porcentual haematocrit reduction and. net weight gain after challenge exposure. Vaccinated animals showed a good degree of protection against challenge with virulent parasites of B. bovís and B. bígemína Venezuelan strains. On the other hand, the combined immunogen was able to induce protection for a relatively long period of time (until14 months) against sequential challenge exposure with heterologous parasites. More over, lyophilized vaccine showed an adecuate degree of stability (31/2 years) after storage at refrigeration conditions. Results indicated serological crossreactivity between B. bovís and B. bígemína antigens, but its correlation with significant cross-protection has not been conclusively proved. Therefore. use of bivalent combjned B. bovís/B. bígemína vaccine appears to be the most rational aproach to prevent bovine babesiosis up to date. BIBLIOGRAFÍA 1. CALLOW, L. L. Vaccination against bovine babesiosis. Advances in Experimental Medicine and Biology 93: 121-123. 1977. 2. CALLOW, L. L. Ticks and tick-borne diseases as a barrier to the introduction of exotic cattle to the tropics. World Animal Review. 28: 20-25. 19878. 3. DE VOS, A. J. Immunogenicity and pathogenicity of three South African strains of Babesia bovis in Bos indicus cattle. Onderstepoort of Veterinary Research 45: 119. 1978. 4. FAO-WHO-OIE. Animal health yearbook. Roma. 1981. 5. KUTTLER, K. L. et al. Efficacy of a nonviable culture-derived Babesia bovis vaccine. American Journal of Veterinary Research 43: 281-284. 1982. 6. KUTTLER, K. L., M. G. LEVY and M. RISTIC. Cell culture-derived Babesia bovis vaccine. Sequential challenge exposure of protective immunity during a 6-month postvaccination period. American Journal of Veterinary Research 44: 1456-1459. 1983. 7. LEVY, M. G. and M. RISTIC. Babesia bovis: continuous cultivation in a microaerophilus stationary phase culture. Science 207: 1218-1220. 1980. 8. LONIBARDO, R. A. Socioeconomic importance of the tick problem in the Americas. PAHO Scientific Publications No.316. 1976. pp. 79. 9. MAHONEY, D. F. Immunization against blood-derived antigens of Babesia. In: Babesiosis. Ed. M. Ristic aand J. P. Kreier. Academic Press, New York. 1981. pp. 475-483. 10. McCOSKER, P. J. The global importance of babesiosis.In: Babesiosis. Eds. M. Ristic and J. P. Kreier, Academic Press, New York. 1981. pp. .1:-24. 11. MELLORS, L. T. et al. Preparation and laboratory testing of a frozen vaccine containing Babesia bovis, B. bigemina and Anaplasma centrale. Research in Veterinary Sciences 32: 194. 1982. 12. MONTENEGRO-JAMES, S. et al. Heterologous strain immunity in bovine babesiosis using a culture-derived soluble Babesia bovis immuno gen. Veterinary Parasitology 18: 321-337. 1985. 13. MONTENEGRO-JAMES. S. et al. Bovine babesiosis: induction of protective immunity with culture-derived Babesia bovis and Babesia bigemina immunogens. Parasitology Research. 74:142-150. 1987. 14. MONTENEGRO-JAMES. S. et al. Estudios sero-epidemiológicos de la babesiosis bovina en Venezuela (Manuscrito en preparación). 15. PIPANO, E. and A. HADANI. Control of bovine babesiosis. In: Malaria and Babesiosis. Eds. M. Ristic. P. Ambroise- Thomas and J. P. Kreier. Dordrecht. The Netherlands, Martinus Nijhoff. 1984.pp. 263-303. 16. PURNELL. R. E. Tick-borne diseases of cattle- a case for pragmatism? Veterinary Review 25: 56-60. 1979. 17. SMITH, R. D. et al. Bovine babesiosis: vaccination against tick-borne challenge exposure with culture-derived Babesia bovis immunogens. American Journal of Veterinary Research 40: 1678-1682. 1979. 18. SMITH, R. D. et al. Bovine babesiosis: pathogenicity and heterologous speciés immunity of tick-borne Babesia bovis and Babesia bigemina infections. American Journal of Veterinary Research 41 : 1957-1965. 1980. 19. SMITH, R. D. et al. Bovine babesiosis: protection of cattle with culture- derived soluble Babesia bovis antigen. Science. 212: 335-338. 1981. 20. TIMMS, P. et al. Babesia bovis: comparison of culture-derived parasites, non-living antigen and conventional vaccine in the protection of cattle against heterologous challenge. Australian Veterinary Journal 60: 75-77. 1983. 21. VEGA, C. A. et al. ln vitro cultivation of Babesia bigemina. American Journal of Veterinary Research 46: 416-420. 1985. 22. WRIGHT, I. G. et al. Protection of Babesia bigemina-Immune animals against subsequent challenge with virulent Babesia bovis. Infection and Immunity 55: 364-368. 1987. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||