|
Veterinaria Tropical 13: 27-42.1988 MODIFICACIONES EN LA PREPARACIÓN DEL ANTIGENO DE AGLUTINACION CAPILAR PARA EL DIAGNOSTICO DE LA ANAPLASMOSIS P. M. Aso*, O. de Nóbrega* y N. Máquez Quivera** *Universidad Simón Bolívar
Departamento de Biología Celular. Recibido: noviembre 18, 1988. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Se reseñan varias adaptaciones y modificaciones de la técnica para la preparación del antígeno a ser utilizado en la prueba de aglutinación para la detección de Anaplasma marginale en tubo capilar. Las modificaciones incorporadas son: 1) la utilización de aislados venezolanos de A. marginale; 2) un único animal infectado sin la necesidad de pasajes sucesivos; 3) la solución amortiguadora de 0,02 M fosfato de sodio sustituye al barbital sódico-ácido barbitúrico de muy limitada y difícil adquisición; 4) no se requiere de una disrupción sónica de flujo continuo; 5) se incorpora en la solución de preservación una mezcla de inhibidores de enzimas proteolíticas que prolonga la antigenicidad del extracto; 6) su almacenaje es más efectivo a -20°C; 7) se observan reacciones positivas en los primeros 5-10 minutos. Este antígeno, aunque es una preparación cruda, muestra una buena especifidad para detectar animales en estado de portador.
La anaplasmosis, enfermedad infecciosa no contagiosa del ganado bovino y producida por la rickettsia Anaplasma marginale, está ampliamente distribuida alrededor del mundo y muy especialmente en las zonas tropicales y sub tropicales incluyendo a Venezuela (9,17,21). Los animales en el estado agudo muestran un descenso rápido del hematrocito debido a una anemia macrocítica multifactorial que origina en el animal fiebre, anorexia y respiración dificultosa (15). Durante esta fase, los eritrocitos, infectados o no, son removidos de la circulación por células fagocíticas, macrófagos y polimorfonucleares (23), probablemente estimulados, entre otros factores, por alteraciones de sus membranas (14) . Los animales que logran sobrevivir esta etapa pasan a un estado de portador y actúan como reservorios de la enfermedad, facilitando la transmisión a otros bovinos a través de las garrapatas y otros vectores. Los animales portadores, aunque pueden vivir largo tiempo, presentan recrudecencias que los debilitan restringiendo su crecimiento, engorde y/o producción de leche, con el consecuente detrimento a la industria ganadera. Más aún, los animales importados para mejorar las razas autóctonas son los más susceptibles, sobre todo los de las especies Bos taurus, y muchos de ellos mueren al poco tiempo de haber sido expuestos a las condiciones del campo venezolano (12). Aunque el diagnóstico de la anaplasmosis en su estado agudo se hace en forma directa mediante el uso de técnicas de coloración y observación microscópica de extendidos de sangre (4), la demostración del estado de portador es mucho más difícil pues generalmente es asintomática con parasitemias menores de 0,1%. La detección de animales portadores a estos niveles, en forma directa o indirecta, es importante desde el punto de vista epidemiológico a fin de evaluar la presencia de la enfermedad en una determinada región o época del año, y para medir el efecto de campañas preventivas tales como la premunición y en un futuro, la inmunización con vacunas protectivas. También son de utilidad en el seguimiento de un brote y en la determinación de la inmunidad del rebaño presente en una población de bovinos particular. Varios métodos serológicos para el diagnóstico de la anaplasmosis han sido reseñados (1,2,5,7,13,16,19,24,27) y algunos de ellos aplicados en Venezuela (9,2 ). Uno de estos métodos, el de aglutinación capilar (16), se fundamenta en que al entrar en contacto el antígeno, preparado a partir de eritrocitos infectados con A. marginale (15), con el suero de animales expuestos al microorganismo, se produce una aglutinación visible dentro de el tubo capilar que contiene los reactantes. Este método, aunque limitado en su sensibilidad, es sencillo, de aplicación directa en el campo y no requiere de anticuerpos secundarios ni de equipo alguno en su aplicación. Sin embargo, no ha sido ampliamente difundido en Venezuela, probablemente debido a que la preparación del material antigénico requiere de reactivos y equipos apropiados de laboratorios más especializados. Este método fue adaptado también para la detección serológica de otras parasitosis (20,25). Se demostró que el antígeno es estable al calor ya los cambios de pH del medio, pero es destruido completamente por la acción de enzimas proteolíticas (26). Inicialmente se recomendó que dicho antígeno debía ser mantenido a 4°C y, posteriormente, se investigó una mejor presentación al incluirse un paso de liofilización (11). Sin embargo, todavía se utiliza para su preparación una solución amortiguadora de barbital y la sonicación en flujo continuo para liberar los cuerpos iniciales de A. marginale. Aunque el antígeno, denominado de aglutinación capilar, no constituye un material puro (3,18,26), utilizado para el diagnóstico de animales en estado de portador para anaplasmosis (10,21,22). El objetivo del presente trabajo fue preparar el antígeno de aglutinación capilar con algunas modificaciones a la técnica original, utilizando aislamientos venezolanos de A. marginale e incorporando o sustituyendo reactivos o etapas a fin de hacerlo más accesible a los laboratorios del país.
Aislamientos de A. marginale Sangre de bovino portador, perteneciente a la Estación -Experimental La Antonia, Facultad de Ciencias Veterinarias, Universidad Central de Venezuela, UCV, San Felipe-Estado Yaracuy, fue inoculada por vía intravenosa a un becerro mestizo esplenectomizado de cuatro meses de edad, libre de anaplasmosis y babesiosis. Cuando la parasitemia alcanzó un valor de 40% se le extrajeron 500 ml de sangre en presencia de una solución anticoagulante de citrato-fosfato-dextrosa (CFD) y 80 ml se centrifugaron a 400 x g por 15 minutos, descartándose el plasma, la capa de células blancas y el nivel superior de eritrocitos. La suspensión celular se congeló inmediatamente por inmersión en nitrógeno líquido en viales plásticos de 4 ml (Giardina, S., trabajo no publicado). Este estabilizado, denominado Yaracuy 1 (Ya-1) contenía 1,2 x 109 parásitos por mililitro; el mismo se ha utilizado en el laboratorio del Departamento de Biología Celular (Universidad Simón Bolívar, Venezuela para infectar subsecuentes animales, inoculando 2 ml IV y 2 ml IM. Preparación del antígeno Se colectaron aproximadamente 400 ml de sangre de un becerro en estado agudo de anaplasmosis, a partir de la vena yugular, en presencia de CFD e inmediatamente centrifugada 1.086 x g por 10 minutos en una centrífuga refrigerada. En todos los pasos sucesivos, las muestras biológicas y las soluciones amortiguadoras se mantuvieron en baño de hielo. El plasma, la capa de glóbulos blancos y los primeros 2-3 m m de los eritrocitos empaquetados se descartaron y las células remanentes se lavaron tres veces con FS (20 m m fosfato de sodio, 150 m m cloruro de sodio, pH 7,2), en una proporción 1:3. El volumen celular final se mezcló con dos volúmenes de la misma solución amortiguadora fría y lotes de 50 mi se homogeneizaron por ultrasonido en un disruptor de células con una punta intermedia durante 10 minutos. La ausencia de eritrocitos intactos se constató mediante observación al microscopio de luz con un aumento de 400x. El material lisado se centrifugó a 6780 x g por 30 minutos y el sedimento total se resuspendió con 30 ml de una solución amortiguadora con sales (SAS). Esta solución se preparó de acuerdo con Ristic (comunicación personal), pero con algunas modificaciones: Solución A: solución amortiguadora 100 m M de fosfato de sodio pH 7,4. Solución B: l,17 mM de MgCI2, 342 mM CaCI2 y 720 mM NaCI. En el momento de usarse, un volumen de la solución A se mezcló con tres volúmenes de la solución B y se diluyó con agua destilada en una proporción 1:4 para luego ajustar el pH a 7,4. Porciones de 8 ml del lisado fueron homogenizadas con 40 pases sucesivos en un homogenizador manual Dounce tipo A, de 15 ml de capacidad, y se centrifugaron en las mismas condiciones anteriores. Este proceso se repitió dos veces más y el sedimento final se resuspendió en 2 ml de SAS, pasándose otras 40 veces por el homogenizador manual antes de congelarlo a -65oC entre 24 a 48 h. El homogenado de eritrocitos infectados se descongeló a temperatura ambiente y se le añadieron 10 ml de SAS para rehomogenizarlo una vez más con 40 pases, seguido de una centrifugación a 6 780 x g por 45 min. El sobrenadante se decantó, el sedimento se resuspendió en 2 ml de SAS, se pasó nuevamente por un homogenizador Dounce tipo S y se centrifugó a 1 086 x g por 30 seg. El sobrenadante, que contenía el material antigénico corpuscular de A. marginale (16) se extrajo cuidadosamente y se mezcló con formaldehido a una concentración final de 0,2%. La mezcla se almacenó por 24 h a 4°C, tiempo después del cual se trasvasó por aspiración a fin de eliminar algún posible sedimento. Adicionalmente, al material antigénico se le añadió una cantidad adecuada de una mezcla de inhibidores proteolíticos, la concentración final fue 5 mM ácido aminocaproíco, 1 mM fenilmetilsulfonil floruro (PMFS). Los dos primeros inhibidores se prepararon en una solución 100x en agua destilada, mientras que el tercero en solución 100x en isopropanol. Con fines experimentales y de control, se preparó una mezcla antigénica siguiendo la secuencia metodológica descrita pero a partir de eritrocitos provenientes de un bovino libre de anaplasmosis. Sueros. Se utilizaron sueros de bovinos sanos infectados experimentalmente con A. marginale; los sueros fueron colectados a diferentes tiempos durante el desarrollo de la anaplasmosis. Todos se mantuvieron a -65°C hasta el momento de la prueba cuando una alicuota de cada uno fue inactivada a 56°C por 30 min. También se incluyeron sueros de animales portadores de campo y de cuatro animales con una infección experimental de Trypanosoma vivax. Prueba de aglutinación. Se siguió el procedimiento descrito por Ristic (16), que consiste en llenar tubos capilares de 13µ I hasta 1/3 del tubo con el preparado antigénico sin diluir y luego los 2/3 restantes con el suero de referencia o problema. El capilar se sella con plastilina por el lado que contiene el antígeno y se coloca en posición vertical con este extremo hacia abajo. Los tubos se incuban a temperatura ambiente sin perturbarlos, hasta observar a simple vista los grumos de aglutinación que se inician a los 10 min con sueros fuertemente positivos. Los resultados se toman a los 30 min ya las 24 h, siempre en comparación con los sueros de referencia. Electroforesis. Con el fin de identificar los componentes del material antigénico preparado por el procedimiento anterior, se corrieron geles en gradiente de poliacrilamida (5-20%) en presencia de dodecilsulfato de sodio (SDS). Se utilizó el sistema vertical con una solución amortiguadora discontinua de Tris-HCL (8). A manera de comparación se incluyeron muestras de una preparación de antígeno soluble y de cuerpos parcialmente purificados de A. marginale.
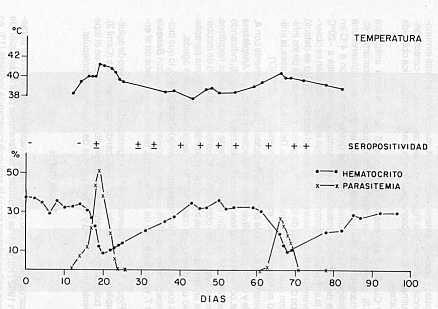
Para la preparación del material antigénico se sustituyó la solución amortiguadora de veronal (barbital) salino (16) por otra que contenía fosfato de Sodio igualmente suplementado con calcio y magnesio. La necesidad de estos iones no fue ensayada en el presente trabajo. Adicionalmente, las parasitemias de los bovinos donantes para la preparación del antígeno estuvieron en el rango entre 28 y 51% de eritrocitos infectados. En el Cuadro 1 , se indican las características de los animales dadores, observándose valores de hematrocito, en el momento de sangrarlos, entre 11 y 23%, lo cual permitió obtener suficiente cantidad de eritrocitos infectados, incluso con sangre tomada al momento de una recrudencia. La Figura 1 muestra el cuadro de anaplasmosis manifestado por el becerro No. 6147, utilizado en el ensayo e inoculado con 4 ml del estabilizado (5 x 109 parásitos) del aislamiento de A. marginale (Ya-1). Se observa el clásico descenso del hematrocito al presentarse un aumento del porcentaje de eritrocitos infectados. Una recrudecencia ocurre a los 61 días con una parasitemia más baja pero con una disminución del hematrocito comparable a la primera crisis aguda. Todo esto acompañado de las respectivas variaciones de la temperatura corporal. En la misma figura se observa que las primeras reacciones seropositivas con la prueba de aglutinación capilar se detectaron 20 días después de la inoculación experimental coincidente con el momento de la máxima parasitemia. Esta reacción incrementa en intensidad y se manifiesta completamente unos 20 días después de la crisis aguda. Con la recrudecencia no se detecta un cambio apreciable del grado
de aglutinación. En el caso particular mostrado en la Figura 1, la
reacción es completamente autóloga, el extracto antigénico utilizado
(1416) se preparó a partir de eritrocitos
infectados del animal (
No.6147) cuyos sueros se están ensayando. Cuando los mismos sueros se
hicieron reaccionar con una mezcla antigénica equivalente (No.1118), pero
preparada a partir de eritrocitos de un bovino sano, no se observó
ningún tipo de aglutinación.
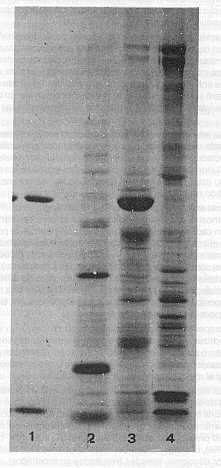
Para los sucesivos ensayos se utilizó el suero del becerro No.6147, correspondiente al día 44 postinfección (No.1462), como suero de referencia positivo. Como control negativo se utilizó un suero de un bovino Holstein puro, adulto, sin antecedentes de anaplasmosis, proveniente de una zona libre de garrapatas y serológicamente negativo a A. marginale mediante inmunofluorescencia indirecta. En la Figura 2, se presenta una reacción característica de aglutinación capilar observada con la preparación antigénica obtenida en este trabajo. En el Cuadro 2 se observa la reactividad de la mezcla antigénica (No.1416) conservada en diferentes condiciones de almacenamiento. Transcurridos 90 días desde la preparación del antígeno, este conserva una notable antigenicidad en aquellos extractos que permanecieron a 4°C en presencia de inhibidores proteolíticos (8). Aunque el almacenaje a -20°C preserva la antigenicidad ligeramente mejor que a 4°C (C), también se observa la conveniencia de la presencia de dichos inhibidores (D). No se detectó ningún tipo de aglutinación de la mezcla antigénica en presencia de los inhibidores con sueros de animales no infectados. Después de 15 meses, la antigenicidad se mantuvo en las muestras almacenadas a -20°C (D'). De treinta y dos sueros de animales infectados experimentalmente con A. marginale y en los que positivamente se detectaron cuerpos de Anaplasma en sangre, ocho de ellos no reaccionaron en el ensayo (Cuadro 3), indicando una sensibilidad del 75%. Sin embargo, de este grupo de falsos negativos, cuatro de los sueros fueron obtenidos en el período prepatente o de incubación de la enfermedad. Otros tres son coincidentes con la máxima parasitemia y sólo uno de ellos se colectó 20 días después de la crisis aguda. En los sueros muestreados no se obtuvo ningún falso positivo, lo que indica una especificidad del 100%. Sueros de bovinos infectados con Babesia sp. o con T. vivax, pero libre de A. marginale, resultaron negativos en el ensayo. En la Figura 3 puede observarse la heterogeneidad del antígeno de aglutinación capilar, el cual presenta unas 25-30 bandas polipeptídicas (Carril 3). De estos polipéptidos sobresalen dos de elevado peso molecular en el tope del gradiente, uno de 67 kd y unas 6 bandas de menor peso molecular.
La utilización de aislamientos autóctonos de A. marginale aumenta la confiabilidad de la prueba al incluir variante antigénicas propias del país y cuyo ciclo intraeritrocítico ha sido estudiado (6). De esta manera, el espectro de antígenos, comunes o propios de los aislamientos locales, se incorporan en la mezcla antigénica a usarse. El aislamiento Ya-1 utilizado en el presente trabajo mostró ser altamente infectivo y virulento, produciendo la enfermedad en animales intactos y esplenectomizados de diferentes razas de carne y leche. Animales infectados experimentalmente con este aislamiento mostraron cuatro y hasta cinco recrudecencias y estabilizados preparados a partir de sangre infectada y mantenidos en nitrógeno líquido, fueron sistemáticamente infectivos al inocularse en bovinos sanos. Estos estabilizados han sido mantenidos bajo estas condiciones en nuestro laboratorio por casi tres años sin haber perdido su infectividad. El material antigénico preparado a partir de sangre de bovinos infectados con Ya-1 mostró una antigenicidad adecuada para realizar la prueba de aglutinación capilar, obteniéndose una reacción claramente positiva a los 10 min. Como el antígeno se obtiene a partir de eritrocitos infectados, uno de los puntos cruciales en su preparación es tener suficientes glóbulos rojos (alto hematocrito) con suficientes cuerpos marginales (parasitemia). En esta experiencia, parasitemias de hasta 46% con hematocrito de 23% dieron rendimientos satisfactorios. Más aún, sangre procedente de una recrudecencia con hematocrito de 19% y parasitemia de 28% (Cuadro 1), también resultó aceptable para la preparación del antígeno. En la preparación del extracto antigénico se utilizó un único becerro esplenectomizado el cual se infectó a partir de estabilizados criopreservados. Esto constituyó un ahorro considerable de tiempo y animales, pues no se requirió un pasaje sucesivo por otros dos becerros, con la ventaja adicional de aprovechar al menos la primera recrudecencia. Dada las características del aislamiento utilizado, es bastante limitada la posibilidad de obtener parasitemias de1 70% y aún contar con suficientes eritrocitos a partir de los cuales preparar el antígeno de aglutinación capilar con un rendimiento adecuado. Por ello se recomienda obtener el antígeno cuando el animal presente parasitemias del orden del 40%. Con bajas parasitemias (23%), la antigenicidad del material obtenido fue bastante menor al medirse por diluciones seriadas (resultados no mostrados). La homogenización por disrupción sónica sin flujo continuo produjo suficientes cuerpos marginales libres para preparar el antigeno. Así mismo, la presencia de la solución amortiguadora de fosfato de sodio sustituyó completamente el uso del barbital (veronal), independizando al investigador de las dificultades para la adquisición de este reactivo de uso restringido. Otro factor que ha limitado la diversificación en el uso de esta prueba es su escaso rendimiento. Un litro de sangre infectada con hematocrito de 20-22% produce 4-5 ml de antígeno. Por estas razones, es muy importante preservarlo adecuadamente de modo de disminuir su degradación. El añadir inhibidores proteolíticos alargó considerablemente la vida útil del antígeno. Esto es especialmente importante cuando se va a aplicar en condiciones de campo, ya que sólo se requerirá un baño de hielo para su mejor conservación y una nevera para su almacenaje por períodos más largos. Aunque la liofilización del antígeno es una alternativa posible (11) requiere del equipo, lo cual es un factor limitante. Por el contrario, las cantidades milimolares en que se utilizan los inhibidores proteolíticos no representan un aumento significativo en los costos de producción de este antígeno. Dado que el rendimiento en la preparación es bajo, una forma de prolongar la durabilidad del antígeno, además de añadir inhibidores de enzimas proteolíticas, es la de ahorrar el material al momento de realizar el ensayo. Por ello se recomienda el uso de microcapilares sin heparina con capacidad de 13µ I de volumen. En el examen de 32 sueros se encontró un 75% de sensibilidad. Aunque la muestra analizada es pequeña, estos resultados están de acuerdo con lo señalado por otros autores (10), especialmente en lo que se refiere a la detección de animales en estado de portadores. Dada la baja sensibilidad de la prueba, ésta no permitió detectar anticuerpos sino 1 -2 días después del máximo de parasitemia, tiempo en el cual probablemente se encuentra suficiente nivel de anticuerpos como para reaccionar en el ensayo y producir la aglutinación (Figura 1). Aunque en este trabajo no se estudió la naturaleza química del antígeno obtenido, es conocido que él representa parte de un antígeno corpuscular asociado con el cuerpo de anaplasma y las membranas de los eritrocitos infectados (18). El mismo es una forma cruda, no purificada, parcialmente libre de hemoglobina pero con membranas de eritrocitos, los cuales pudieran contener parte de los autoantígenos reseñados en la anaplasmosis (3). Los resultados de la electroforesis en geles de poliacrilamida (Figura 3) muestran esta heterogeneidad, pudiendo identificarse hasta 30 bandas polipeptídicas. Actualmente se está analizando la reactividad del antígeno Ya-1 con sueros provenientes de distintas regiones del país, como parte de un estudio más amplio con el objeto de comparar antigénicamente los aislamientos venezolanos de A. marginale. También se espera preparar antígeno de aglutinación capilar a partir de otros aislamientos geográficos a fin de determinar grados de homologías antigénicas.
Several modification concernig the obtention of Anaplasma marginale antigen used in the capillary agglutination test were determined in order to facilite its preparation. Some of them are: 1) Venezuelan isolates of A. marginale used as initial material; 2) only one animal was used without the need of serial passages; 3) the original veronal buffer saline was substituted for sodium phosphate buffer which is not under goverment restrictions; 4) the continuos flow sonication was substituted for Batch sonication; 5) during the antigen preparation a mixture of proteolitic inhibitors was included, 6) the final product was stored at -20°C in the presence proteolitic inhibitors. Under these conditions, positive reactions were developed in 10 to 20 minutes with good specificity.
1. AMERAUL T, T. E. and T. O. ROBY. A rapid card agglutination test for bovine anaplasmosis. J.A.V.M.A. 153:1828-1834. 1968. 2. BARRY, D. N., R. J. PARKER, A. J. DeVOSS, P. DUNSTER and B. J. RODWELL. A microplate enzyme-linked immunosorbent assay for measuring antibody to A. marginale in cattle serum. Aust. Vet. J. 63: 76- 79. 1986. 3. DIMOPOULLOS, G. and D. BEDELL. Mechanism and specificity of the capillary tube-agglutination test for diagnosis of anaplasmosis. Am. J. Vet Res 35:1567 -1570. 1974. 4. DONOVAN-MYHAND, J.; L. HART, C. LlU, C. OHRBERG and C. SEGER. A rapid staining procedure for Anaplasma marginale in bovine erythrocytes. Am. J. Vet Res. 45:2143-2144. 1984. 5. FRANKLIN, T.,F. HECK and J. HUFF. Anaplasmosis complement fixation antigen production. Am J. Vet Res 24:483-487. 1963. 6. GIARDINA, S., A. BRETAÑA and N. MARQUEZ. Ultraestructural aspects of intra erythrocytic development of Venezuelan strain of Anaplasma marginale. Tropenmed. Parasit 34:710-716. 1983. 7. GOFF, W., A. BARBET, A. D. STILLEN. G PALMER, D. KNOWELS, K. KOCAN, J. GORHAM and T. McGUIRE. Detection of Anaplasma marginale infected tick vectors by usíng cloned DNA probe. Proc. Nat Acad. Sci. 85:919-923. 1988. 8. HAMES. B. D. and D. RICKWOOD. Editores. Gel electrophoresis of proteins. IRL Press, Oxford. 1981. p. 33-76. 9. JAMES, M., A. CORONADO, W. LOPEZ, R. MELENDEZ and M. RISTIC. Seroepidemiology of bovine anaplasmosis and babesiosis in Venezuela. Trop. Anim. Hlth Prod 17:9-18. 1985. 10. LOHR, K. F., J. P. ROSS and H. MEYER. Studies of homologous and heterologous antibody responses to infections with. Anaplasma marginale and A. centrale using indirect fluorescent antibody and capillary tube agglutination test. Tropenmen. Parasit. 24:86-95. 1973. 11. MALHOTRA, M., M. RISTIC and M. LEVY. Preservation by liophilization of anaplasmosis capillary tube-agglutination test antigen. Am. J. Vet. Res. 43:368-369. 1982. 12. MARQUEZ, N. Manejo clínico de las enfermedades hemáticas. Monografia. 1984. 13. MONTENEGRO-JAMES, S., M. JAMES and M. RISTIC. Modified indirect fluorescent antibody test for serodiagnosis of Anaplasma marginale infections in cattle. Am. J. Vet. Res. 46:2401-2403. 1985. 14. NORDELO, .M. A. and M. YSERN-CALDENTEY. Abnormal bovine erythrocyte membrane proteins and glycoproteins during and after infection with Anaplasma marginale. Biochem. Bioph. Res. Communication 104:664-672. 1982. 15. RICHEY , E. J. Bovine anaplasmosis In: Veterinary Therapy. Howard, J. editor. 1981. p.767-772. 16. RISTIC, M. A capillary tube-agglutination test for anaplasmosis. A preliminary report. J.V.M.A.141:588-594. 1962. 17. RISTIC, M. Anaplasmosis, In: Disease of cattle in the tropics. Ristic y Mclntyre, editores. 1981 p.327-344. 18. RISTIC, M. y J. P. KREIER. Anaplasmosis. XV. Morphologic and chemical properties of the antigen used in the capillary tube agglutination test. Am. J. Vet. Res. 24:985-992. 1963. 19. RISTIC, M., F. H. WHITE and D. A. SANDERS. Detection of Anaplasma marginale by means of fluorescent-labeled antibody. Am. J. Vet. Res. Oct:924-928. 1957. 20. ROSS, J. P. The detection of circulating trypanosamal antibodies by capillary-tube agglutination test. Ann. Trop. Med. Parasit. 65:327 -333. 1971. 21. SCHROEDER, W. F., C. LEON, M. TORO and R. LOPEZ Anaplasmosis: Prevención y control. Fondo Nacional de Investigaciones Agropecuarias, MAC. 1971. 22. SMITH, R. D., A. WOOLF, L. HUNGERFORD and J. SUNDBERG. Serologic evidence of Anaplasma marginale infections Illinois white-tailed deer. J.A.V.M.A. 1ti:1254-1256. 1982. 23. SOLER, A. M. Aspectos de la respuesta inmunitaria durante la anaplasmosis bovina experimental. Tesis doctoral. Instituto Venezolano de Investigaciones Científicas. 1988. 24. THOEN, C., B. BLACKBURN, K. MILLIS, J. LOMME and M. HOPKINS. Enzyme-Iinked immunosorbant assay for detecting antibodies in cattle in a herd which anaplasmosis was diagnosed. J. Cllinical Microbiol. 11 :499-502. 1980. 25. TORO, M., A. LEON, A. LOPEZ, J. GARCIA y A. RUIZ. Resultados de un muestreo sobre tripanosomiasis bovina mediante técnicas serológicas. Veterinaria Tropical 5:43-50. 1980. 26. WELTER, C. J. and F. ZUSCHEK. Properties of Anaplasma marginale antigen used in capillary tube-agglutination test. Am. Vet. Med. Assoc. J. 141 :595-599. 1962. 27. WINKLER,G.,G. BROWNandH. LUTZH. Detection to antibody to Anaplasma marginale by an improved enzyme-linked immnuosorbent assay with sodium dodecyl sulfate disrupted antigen. J. Clin. Microbiol. 25:633-636. 1987. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||