|
Veterinaria Tropical 10: 59-87. 1985 REVISIÓN DE LITERATURA ASPECTOS EPIDEMIOLÓGICOS
SOBRE LA INTOXICACIÓN PARALÍTICA POR MARISCOS
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
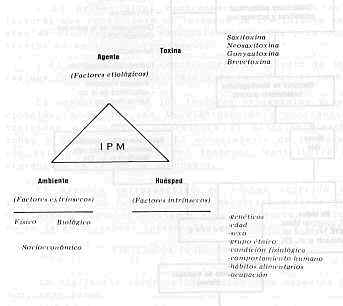
INTRODUCCIÓN En el océano ocurren múltiples ciclos de cadenas alimentarías, en donde la energía adquirida, principalmente por fotosíntesis, es tranferida de un organismo a otro en forma de moléculas orgánicas. Estos metabolitos pasan, en muchos casos, desapercibidos por el hombre, pero otras veces provocan trastornos graves, como es el caso de la Intoxicación Paralítica por Mariscos (IPM). Esta es una intoxicación biológica ocasionada por la ingestión de mariscos marinos, principalmente moluscos bivalvos (mejillón), los cuales contienen potentes neurotoxinas producidas por organismos unicelulares del plancton, denominados dinoflagelados. La asociación de intoxicación con el consumo de mejillones, trajo como consecuencia que, a comienzos de siglo, se le diera el nombre poco acertado de "mitilolotina" a la causa de la intoxicación de milidio mejillón; en investigaciones posteriores se observó que la toxina se acumulaba en los moluscos y crustáceos que se alimentaban del fitoplancton compuesto, principalmente por dinoflagelados y diatomeas, siendo los primeros un grupo mixto de taxonomía no bien definida (19). El crecimiento de dinoflagelados tóxicos en criaderos de moluscos, puede ocasionar brotes de la enfermedad y la muerte a personas que consuman moluscos, como alternativa proteica de alto valor nutritivo y por su gran palatabilidad. Los aspectos del proceso que conducen a la toxicidad del marisco están claros, a diferencia de los factores que inducen el crecimiento masivo de los dinoflagelados, conocido como " marea roja". En Venezuela, el conocimiento epidemiológico de la IPM es escaso, por lo que urge realizar estudios que permitan dilucidar los factores que conforman la cadena epidemiológica de la enfermedad. Esta es la razón por la cual se hace una revisión de los factores asociados con el crecimiento de los dinoflagelados, diferentes tipos de toxinas, distribución y ocurrencia de la enfermedad. Se propone un modelo epidemiológico y un programa de vigilancia epidemiológica, además de consideraciones que permiten evaluar la ocurrencia de la IPM en el país. CUADRO CLÍNICO Y TRATAMIENTO En el hombre y los animales, los síntomas de la IPM son de origen nervioso y pueden presentarse en forma inmediata después de la ingestión de moluscos y/o crustáceos que posean la toxina, siendo así una clásica intoxicación alimentaría. Los primeros síntomas de intoxicación son: sensación de cosquilleo en los labios, lengua y punta de los dedos, seguida por insensibilidad; luego se presenta incoordinación muscular y finalmente parálisis ascendente, produciéndose la muerte a consecuencia de parálisis respiratoria en un tiempo entre dos a doce horas (6,14,18). Si se superan las doce horas, el pronóstico es bueno (30). Se cita una letalidad del 10% (3). Debido a que no se conoce antídoto para la toxina, el tratamiento inmediato es sintomático, recomendándose la inducción al vómito, lavado gástrico, enema, uso de soluciones alcalinas y respiración artificial (7,14,18). Se han señalado amplios rangos de susceptibilidad humana a la toxina, presentando algunos individuos una tolerancia natural a cantidades considerables de toxina y otros una tolerancia adquirida (17), planteándose así el efecto del status inmunológico sobre la enfermedad, hecho no estudiado a cabalidad hasta el momento y que genera una conducta de respuesta entre huésped susceptible y toxina que requiere de una investigación. DIFERENTES TIPOS DE TOXINAS Y AGENTES PRODUCTORES La IPM es causada por un grupo afín de bases tetrahidropurínicas. Shimizu (28) cita un total de nueve toxinas aisladas de varias fuentes, estas toxinas son consideradas los más potentes tóxicos no proteicos conocidos por el hombre; la cantidad de 1 mg por vía oral es considerada letal para el hombre (14). La toxina más estudiada es la saxitoxina (Stx), )a cual lleva ese nombre, ya que fue extraída del Saxidomus giganteus (almeja gigante). La Stx producida por el Gonyaulax catanella es un sólido blanco, higroscópico, termoestable, muy soluble en agua, ligeramente soluble en metanol y etanol, pero insoluble en la mayor parte de los disolventes orgánicos no polares (8). Posee un peso molecular (PM) de 299. Es estable en soluciones ácidas y se destruye en soluciones alcalinas. Presenta un rango de pK entre 8,2 y 11,5. Su fórmula molecular es C10H 17 N7 O4 2 HCI (27). Se observan similitudes químicas y farmacológicas entre las toxinas aisladas del género Gonyaulax. Existe otra toxina que es un ester sulfónico de la Stx (sulfato de 11-hidroxisaxitoxina) ; es una sustancia neutra o ligeramente básica, su fórmula molecular es C 10H16 N7O8 S, con un PM de 394. Esta toxina con sus epímeros son a veces denominados Gonyautoxinas (Gtx) (28) . La Food and Drug Administration (30) informa sobre la producción de derivados de la Stx, tales como neosaxitoxin o 1-N-sulfo-gonyautoxina III. Los epímeros de esos derivados con la Stx hacen un total de doce toxinas, agrega que existen otros dinoflagelados que producen IPM, pero la estructura química de la toxina no ha sido determinada, a pesar de que Yon-Yen et al. (32), en 1981, habían separado y purificado una mezcla de toxinas y obtenido el aislamiento de otras toxinas, con una estructura sin precedentes en productos naturales, denominándolas Brevetoxinas (BTx), debido a que fueron producidos por el dinoflagelado Ptychodiscus brevis (Gymnodiniu. breve). Estos investigadores señalan a la BTx-A, BTx-B y BTx-C, presentándose en mayor cantidad la BTx-B, la cual posee un Pm de 894 y una fórmula molecular C50H07O14, dispuesta en una rígida estructura en escalera consistente en once anillos con enlaces eter trans. La toxicidad de la BTx es semejante a la STx ya la GTx. La Stx y la GTx (toxina sulfatada) actúan bloqueando el transporte de sodio a través de la membrana de las células nerviosas y moleculares (30) y la BTx intensifica el transporte de sodio, produciendo esta última un incremento en la conducción nerviosa, seguida por depresión (5). Las BTx son solubles en lípidos y aparentemente responsables de muerte masiva de peces y de otras faunas marinas asociadas a la marea roja, de intoxicación en moluscos y en humanos en las costas de Florida y el Golfo de México ( 32). Las toxinas en el mejillón se concentran en su aparato digestivo (hepatopancreas), de igual manera ocurre en las vieiras, consiguiéndose menor cantidad de toxina en el músculo abductor o porción comestible aunque Jamieson y Chandler (9) destacan que no es igual para todas las especies de vieiras. Como excepción, los moluscos de Alaska la concentran en el sifón (8). En 1979, Shimizu (28) señaló que los dinoflagelados implicados en la IPM y la mortalidad masiva de peces, podían producir toxinas diferentes y que muchos casos de IMP no fueran probablemente causados por una Stx, sino por una mezcla de varias de ellas. Este hecho fue apoyado por Reichardt et al. (23) quienes plantearon la posibilidad de la existencia de más de una toxina en moluscos tóxicos en Alaska. Aunado a esto, se ha señalado la existencia de cepas atóxicas hasta extremadamente tóxicas, variando las últimas en grados de toxicidad (28); de acuerdo con ello, Jamieson y Chandler (9), comprobaron la existencia de fluctuaciones considerables de toxicidad en meses adyacentes a la floración o desarrollo masivo de los dinoflagelados. En 1967, Prakash (22) encontró que la producción de toxina, en un tipo de dinoflagelado cultivado, es una función de la densidad celular. Observó, además, la variabilidad de producción de toxinas entre diferentes especies del género Gonyaulax, siendo la G. tamarensis cinco a diez veces más tóxica que la G. catanella (Cuadro 1). El mismo autor, en sus estudios, aborda las siguientes interrogantes:
En relación a la primera interrogante, tanto la forma planctónica como la forma bentónica, y sus estadios intermedios de un probable ciclo de vida de la G. excavata, son considerados como tóxicos (5). Es fundamental conocer el ciclo de vida de los dinoflagelados tóxicos y los efectos del medio ambiente sobre el ciclo, para predecir y/o controlar con mayor precisión la floración. Los informes de Prakash (22) y Anderson y Morel (1), destacan que la germinación de los quistes de dinoflagelados, se inicia por cambio de temperatura. Ayres y Cullum (2) plantean, como disyuntiva, si la toxicidad del molusco se debe a floraciones de dinoflagelados (fase planctónica) o es producida por una exposición permanente de bajo número de dinoflagelados (fase bentónica). En 1982, en el trabajo de Reichardt et al. (23), presentado en las Primeras Jornadas Técnicas de Moluscos Gallegos: Mejillón, una de las conclusiones fue la necesidad de investigar el rol de la forma quística de los dinoflagelados. Con respecto a si es una endo o exotoxina, Prakash (22) demuestra, con G. tamarensis, una pérdida progresiva de la toxina en el medio que rodea a la célula producto. En cuanto a la tercera interrogante, Provasoli, citado por Prakash (22) demostró que la toxina no es de origen bacteriano, cuando aisló con éxito a la G. tamarensis en cultivos axénicos y comprobando toxicidad. En relación a la estabilidad, los extractos ácidos crudos de la toxina de G. tamarensis se logran mantener por varios meses. Almacenamientos por un año bajo congelación o refrigeración no alteran apreciablemente la potencia de la toxina (5).
Medcorf et al. (17) señalan que el proceso culinario doméstico reduce la toxina, pero no ofrece suficiente protección, señalando el proceso del enlatado como más eficiente. Halstead y Schantz (8) apuntan que el tratamiento por calor, incluso el enlatado, sólo destruye parcialmente a la toxina, y citan a la congelación y otras formas de elaboración o conservación como eficaces para eliminar o destruir la toxina. En cuanto a los agentes productores de toxinas, ya se han mencionado algunos. Mira (18). en 1970. efectúa una buena revisión, presentando una lista de 23 dinoflagelados tóxicos para el hombre. entre los cuales se pueden mencionar los siguientes: Gonyaulax catanella, G. acatanella, complejo Gonyaulax tamarensis excavata, G. polyhedra, Noctiluca scintillans, Gymnodinium breve (actualmente Ptychodiscus brevis), G. veneficeun, Prorocentrum sp., Pyrodinium phoneus y P. bahamense. Los dinoflagelados. miembros del fitoplancton, por diversos factores aumentan en densidad, llegando en ciertos casos a formar hematotalasias o mareas rojas (Organización Mundial de la Salud, (20), que pueden estar asociada o no a la contaminación de los moluscos que crecen en la zona: éste es un fenómeno ampliamente distribuido en el mundo (21). Es importante mencionar ciertos casos de intoxicación por mariscos, que se relacionan con otro tipo de toxina que, ocasionan un cuadro de tipo gastrointestinal, de carácter más suave, causando después de cinco a seis horas de su ingestión vómitos, dolor abdominal fuerte y diarrea, que desaparecen en un periodo de dos días (11,12). En un brote ocurrido en Holanda, en 1981, con sintomatología gastrointestinal, se inculpó al bivalvo Mytilus edulis y se encontró al momento del brote a los dinoflagelados Prorocentrum micans y Dinophysis acuminata. Al estudiar el bivalvo, se consiguió dos toxinas, principalmente la ácido okadaico y, en menor grado, un derivado de acyl de dinophysis toxina-1 (DTX-1) (10). Es importante señalar que en los chequeos rutinarios que se realizaban en la zona, no se habían encontrado, hasta el momento del brote, los dinoflagelados tóxicos sospechosos. En el curso de las investigaciones, los dinoflagelados desaparecieron rápidamente aunque la toxina en los moluscos fue eliminada muy lentamente, reconociéndose que éste fue un brote localizado y violento. Los mismos autores (10) reseñan otro brote en Holanda en 1981, con sintomatología gastrointestinal, producido
por moluscos importados de España y, en ese mismo momento, en la zona de
la Ría de Vigo, se observó cantidades crecientes de Prorocentrum
micans y bajo número de Gonyaulax tamarensis y Dinophysis
acuminata. Síntomas similares a los de Holanda habían sido
observados en Japón, implicando a la DTX producido por el Dinophysis
fortii (11). FACTORES
AMBIENTALES NUTRICIONALES QUE INCIDEN SOBRE EL DESARROLLO DE LOS
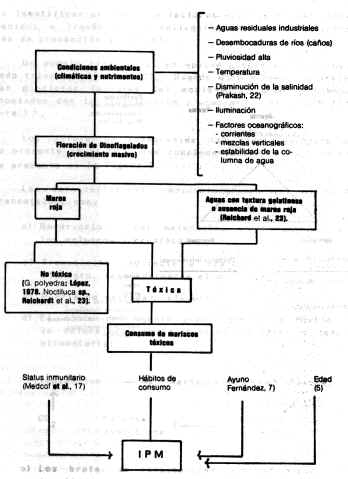
DINOFLAGELADOS Los dinoflagelados se encuentran distribuidos ampliamente y son elementos importantes en la cadena alimentaría marina. La densidad de los dinoflagelados en agua, en condiciones normales de salinidad, es de 1.000 cel/litro, pudiendo alcanzar cifras de 1 x 108 cel/litro. Cantidades de 250.000 cel/litro producen la muerte de los peces por anoxia (21); niveles de 200 cel/ml hacen tóxica el agua y, al superar los 20.000 cel/ml, la enrojecen. Existen aproximadamente 1.200 especies, de las cuales pocas son venenosas. La floración o pico de crecimiento de los dinoflagelados tóxicos ocurre regularmente, pero la de los dinoflagelados ocurre de un modo esporádico e inexplicable (8,30). Los factores o características que permiten la floración son desconocidos, pero podrían estar involucrados los siguientes: Necesidades nutricionales especificas, temperatura del agua, radiación solar, modalidades meteorológicas que conducen a movimientos de masas de agua, mezcla de la acción de corrientes ascendentes y de las mareas, y desarrollo de un termoclima (una capa superior de agua que no se mezcla con al agua subyacente). En la costa noreste de Inglaterra, las floraciones se presentan en forma anual (2) y van acompañadas o precedidas por un mar y un tiempo en calma, que favorece el crecimiento exponencial de los organismos fitoplanctónicos (5). Se presentan luego de períodos secos y en zonas ricas en sustancias orgánicas e inorgánicas (pluviosidad, desagües, caños). Pueden iniciarse en aguas oceánicas entre 15 a 50 Km de la costa (14) y a 12-35 m de profundidad (14). En 1947, Medcof et al. (17) mencionaban que existe anualmente un período de mayor peligrosidad anual, correspondiente a finales de verano y con una duración menor a dos meses. Los períodos en que los niveles de toxicidad son máximos, varían algo según la situación geográfica. Por razones desconocidas, la especie tóxica G. catanella florece a lo largo de las costas oeste y noreste de Norteamérica, sobre Japón y la costa de Chile. La G. tamarensis var. excavata (otras referencias lo citan como un complejo), florece a lo largo de la costa noreste de Estados Unidos, costa este de Canadá (9) y las costas de los países que limitan el Mar del Norte (28, 30). Estudios de Prakash (22) con G. tamarensis demuestran, a nivel de cultivo, que baja salinidad y aumentos de temperatura favorecen su crecimiento, aunque la salinidad parece ser un factor ecológico más importante que la temperatura para controlar la abundancia del dinoflagelado en forma natural. El G. tamarensis consigue un crecimiento óptimo a niveles de 19 - 20% de salinidad y con un rango de tolerancia de 7 - 40%. Señala Prakash (22) que en el plancton en la Bahía de Fundy (Canadá), G. tamarensis aparece a finales de junio cuando la salinidad superficial es de 31% y una temperatura de 8°C, aproximadamente. Aunque pueden esperarse variaciones anuales, como una regla, esta especie alcanza su pico en aguas cercanas a la costa a finales de julio o comienzo de agosto,. Hacia finales de septiembre decrece marcadamente y a finales de otoño desaparece completamente del plancton. Se relaciona su desaparición a predadores denominados "tintinnids" y aumentos de salinidad (mayor de 32%). Prakash (22) cita que, a nivel oceánico, el factor controlador es la temperatura, pero en zonas costeros y estuarios es la salinidad. En estudios sobre vieiras se mencionan picos de toxicidad durante los meses de otoño e invierno (9). Los requerimientos nutricionales comprenden oligoelementos disponibles, agentes quelantes, vitaminas y materia orgánica en partículas o disuelta. En G. tamarensis (22), los requerimientos son nitrato, vitamina B12 y tiamina; las dos últimas son esenciales en forma conjunta. Prakash (22) cita un factor orgánico asociado con la fracción del "humus", que presenta un marcado efecto estimulante sobre el crecimiento de G. tamarensis. En lo que respecta a Ptychodiscus brevis, se relaciona su estimulación con fosfatos, nitratos y amonios, provenientes de fertilizantes o desechos industriales (5). Este último aspecto lo señala igualmente López (14), como un factor que estimula la floración de dinoflagelados. En general, se requiere la combinación adecuada de cierto número de factores físicos y biológicos reseñados en el Cuadro 1, pero es de resaltar que el comienzo de la proliferación depende de la presencia de quistes en la capa floculenta de la superficie de contacto entre el agua y el sedimento. Así como aparecen en forma súbita, los dinoflagelados suelen desaparecer rápidamente, debido a varios factores, siendo el más importante el agotamiento de nutrimentos. En Vigo (España), en 1955, bastó la entrada de una considerable masa de agua atlántica en la bahía, para que desaparecieran los dinoflagelados, posiblemente por una dilución de los nutrimentos (5). Conceptos epidemiológicos sobre la enfermedad Epidemiología es el estudio de los factores que determinan la distribución y ocurrencia de eventos de enfermedad en una población. Sus objetivos son descubrir y medir la enfermedad y factores (agente, huésped y ambiente), evaluar posibles asociaciones entre ellos y la distribución y frecuencia de enfermedades (15). El objetivo final es identificar un factor o factores que puedan ser intervenidos a través de la aplicación de medidas eficientes de prevención y control. Un modelo tradicional en epidemiología es el denominado triada ecológica (13). Usando este modelo, se presentan distintos factores del ambiente, agente y huésped asociados con la distribución y ocurrencia de la IPM (Figura 1) . Los diferentes componentes han sido reseñados en la presente revisión. Una complementación de este modelo se presenta en la Figura 2. Las características epidemiológicas del ciclo de transmisión, son:
En el caso de la IPM, los estudios para establecer asociaciones epidemiológicas entre un (os) factor (es) y la enfermedad, pueden dividirse en dos niveles: - El primer nivel comprendería el estudio de los factores que condicionan el fenómeno de crecimiento explosivo de dinoflagelados, producción de toxina y su concentración en moluscos y crustáceos - El segundo nivel comprendería el estudio de factores que condicionan la ocurrencia de la IPM en el hombre. El conocimiento de los factores ambientales y nutricionales, asociados con la distribución y ocurrencia de toxicidad en moluscos, permitirá el establecimiento de zonas y épocas de vida. El conocimiento de la ocurrencia estacional o cíclica del fenómeno contribuirá a la prevención de la IPM en el hombre. El estudio retrospectivo de brotes ocurrido o la investigación de futuros brotes, permitirá definir grupos de riesgo y factores asociados a su ocurrencia, permitiendo su caracterización epidemiológica, control y prevención. VIGILANCIA EPIDEMIOLÓGICA La vigilancia epidemiológica comprende aspectos básicos como son: -
Recolección de información El principio fundamental en el establecimiento y funcionamiento de programas preventivos, es determinar elemento en la cadena epidemiológica más asequible y vulnerable que pueda ser eliminado o controlado. Actualmente se ha identificado a las toxinas como causales directas. En el desarrollo de programas preventivos contra la IPM, las medidas están dirigidas a evitar el consumo de mariscos, especialmente mejillones que contengan dosis tóxicas de toxinas, y no específicamente dirigidas hacia la eliminación del dinoflagelado productor de toxinas. Es importante el conocimiento de todos aquellos factores que, en un momento dado, puedan inducir la aparición de la enfermedad. así como también la historia natural de la misma. ya que es la única vía objetiva que permitirá la aplicación de un efectivo programa de control con medidas de carácter preventivo o curativo. De acuerdo a las notaciones anteriores. la IPM se presenta en forma de brotes violentos y esporádicos, asociados o no a la presencia de marea roja y debida al crecimiento masivo o no de dinoflagelados tóxicos. El problema se acentúa cuando se observan todos los posibles factores asociados (Cuadro 1); además, en los moluscos tóxicos no se presenten cambios organolépticos que alerten al consumidor y, como ya se mencionó. el cocido ordinario o industrial de los moluscos no destruye el peligro de intoxicación. Todos estos aspectos deben conducir a ampliar estudios de los elementos de la tríada de la enfermedad. En Venezuela. el problema de salud pública no ha sido mayor. debido a la existencia de programas de vigilancia desarrollados por las agencias de salud locales y estatales, que miden la toxicidad en lotes de mariscos y moluscos; este procedimiento ha salvado muchas vidas humanas. Otro problema que ocasiona el fenómeno de la IPM es su efecto negativo sobre la industria de mariscos. Como dato, en una zona de América del Norte, las pérdidas económicas para las industrias pesqueras y marisqueras, incluyendo los efectos secundarios, como consecuencia de un brote local, ascendieron a más de un millón de dólares (8). En Venezuela, el brote de 1977 dejó como secuela la muerte de varias personas (se reseñará más adelante), y la prohibición total de toda actividad económica relacionada con el mejillón o la pepitona, paralizándose un total de casi 500 toneladas de mejillones cultivados, hasta que los niveles de toxicidad hubieran desaparecido; esto se traduce en fierre de mercados y pérdidas financieras para el criador (M.V. Gustavo Toro Alayón, Jefe División de Higiene de los Alimentos. Ministerio de Sanidad y Asistencia Social (comunicación personal)). Este aspecto trae como consecuencia la actuación de organismos oficiales reguladores, como la Food and Drug Administration, la que acepta como limite superior 80 µg de toxina/100 g de carne de molusco, equivalente a 500 Unidad Ratón (UR) (30). La gravedad de los efectos de la IPM ha llevado a muchos países a ejecutar actividades de prevención y ésta sólo se consigue mediante una cuidadosa vigilancia de los niveles de toxina en los mariscos. La vigilancia de la toxina se mantiene durante todo el periodo en que es probable que aparezcan los dinoflagelados tóxicos, ésto varia de acuerdo a la región. Mira (18), en España, lo cita de mayo a octubre, y si la toxina es encontrada, toda la cría de esa área debe ser suspendida hasta que la floración de dinoflagelados haya pasado y toda la toxina haya sido eliminada por los moluscos, procedimiento que dura de cuatro a seis semanas (fuera del periodo de cosecha). En Alaska. donde el problema de la IPM es grave, se observa que el Saxidomus giganteus retiene la toxina por más de dos años en bancos naturales (23). Para abreviar estos periodos se probó con depuración, pero este procedimiento resulta costoso, consume tiempo y no puede ser recomendado para cualquier cantidad de mariscos (30). Para conocer los niveles de toxina en moluscos, en la actualidad se utiliza el bioensayo en ratón, debido a que es una prueba simple y segura, recomendada y aceptada por la FOA (30), aunque tiene limitaciones en cuanto al requerimiento de ratones de 20 g de peso vivo. Bates y Rapoport, citados por López (14) han desarrollado ensayos químicos que se fundamentan en la determinación de productos metabólicos de la Stx. resultando esta prueba ser 100 veces más sensible que los bioensayos. Reichardt et al. (23) realizaron un ensayo colorimétrico basado en la degradación oxidativa de la Stx. cuyos resultados pueden correlacinarse con el bioensayo en ratón, sólo requiere de dos horas, puede realizarse en los sitios de recolección y presenta una sensibilidad de 0,5 µg de Stx. Burdaspal (4) ofrece una recopilación de varios métodos, donde observa un bioensayo utilizando mosca doméstica (Musca domestica). La FDA (30) señala que las pruebas químicas mencionadas son complicadas, requieren equipos costosos y no cubren los requerimientos que ellos exigen; enfatizan la necesidad de investigar en ese campo para desarrollar pruebas inmunológicas especificas para la toxina que sean de fácil manejo, rápidas y preferiblemente realizadas en los sitios de recolección, para así evitar el manejo de mejillones tóxicos, otra necesidad que destacan es la de desarrollar un antídoto para la toxina. que pueda ser aplicado conjuntamente con la respiración artificial, para el tratamiento de personas intoxicadas. Se han estudiado medidas contra el dinoflagelado. Taylor (29) reseña los trabajos de Marvin y Proctor, con la finalidad de desarrollar un control químico selectivo contra el Gymnodinium breve; como resultado encontraron que de 430 compuestos probados, sólo cinco mostraron ser eficientes, pero los mismos son antieconómicos. Cita el mismo autor que el control biológico pudiera ser una alternativa para su control; menciona al Amoebophrya ceratii, endoparásito del Gonyaulax catanella, como una vía de posible estudio. Se menciona. igualmente, el traslado de los bivalvos a zonas libres, medida impráctica y antieconómica. La cocción y variación del pH del mejillón tóxico es un método poco seguro que puede disminuir la calidad comercial del producto. También se han realizado ensayos, a nivel experimental, para inactivar la toxina mediante la utilización del gas ozono. Ello es eficaz, pero la relación costo-eficiencia y la alteración del sabor son inconvenientes. En programas de vigilancia epidemiológica, el conocimiento de indicadores es fundamental para la prevención. En el caso de la IPM el indicador más difundido es la marea roja; la cual, con todas las limitaciones de la misma, previene brotes de la enfermedad. Otro indicador podría ser la mortandad de peces y/o aves marinas, variando su utilidad de acuerdo a la región, tipo de toxina y especies afectadas. pero el más usado es la determinación de toxicidad en mariscos, ya que se ha demostrado ser el más eficiente en todo el mundo. En resumen, la vigilancia epidemiológica se fundamenta en detectar los niveles de toxina en los mariscos y, cada programa o sistema. deberá ser adaptado a la zona, región o país en el cual va a ser aplicado. Fundamentalmente, deben tomarse en consideración los siguientes aspectos: a) Incidencia en la
enfermedad y sus efectos sobre la población y economía del país.
c) Recursos disponibles (humanos y tísicos). LA ENFERMEDAD EN VENEZUELA El 3 de mayo de 1977 se reporta el primer brote de la IPM en la población de Manzanillo, estado Nueva Esparta, con un total de 15 casos, uno de ellos fatal, ocurrido en una niña de dos años de edad, a consecuencia de un cuadro asfíxico luego de quince horas de haberse iniciado los síntomas (7,24). Posteriormente, entre el 31 de julio y el 1° de agosto del mismo año, en la zona comprendida entre Río Caribe y San Juan de las Galdonas, estado Sucre, se presentan aproximadamente 209 casos con 9 muertes, con sintomatología, principalmente, de tipo nervioso (25,26). Halstead y Shantz (8) reconocen estos primeros casos venezolanos como uno de los mayores brotes reportados. El tiempo de aparición de los síntomas, fue entre 10 minutos y 14 horas. La cantidad consumida de mejillones fue de 2 a 18 ejemplares, siendo preparados en forma de guisado, salcochados y asados. En relación a la distribución de enfermedad por grupos etarios (Cuadro 2), se observa una marcada influencia de la edad, ya que el 77,7% de las muertes ocurrió en menores de 9 años (6), variando la cifra de casos fatales entre 1 y 10%, con una tasa media de 8,5% (7). Se evidenció toxicidad en mejillones y pepitonas captados en la zona, mediante el bioensayo en ratón. Como medida se prohibió la explotación y comercialización de la especie mejillón hasta tanto no disminuyan sus niveles de toxicidad (Resolución N° 405 del Ministerio de Agricultura y Cría, aparecida en 5 de agosto de 1977 en Gaceta Oficial). Como dato resaltante, los pescadores dijeron observar en las aguas como una babasa, siendo ésto lo único extraño (5). El 26 de agosto de 1977, la Dirección de Salud Pública nombró una Comisión para establecer un sistema de vigilancia epidemiológica, cuyo trabajo se basaría fundamentalmente en la toma de muestras de mejillón fresco y agua en las zonas de producción natural y en la zona de cultivos, con frecuencia variada de acuerdo a la zona afectada. Una vez analizadas las muestras, el médico veterinario de la Oficina de Salud local, estaba autorizado para permitir el consumo de dichos mejillones. La efectividad de la medida seria evaluada rutinariamente (26).
Además, debían observarse las variaciones hidrológicas de diversas zonas en forma periódica y sistemática, así como estudiar la densidad, tipo y toxicidad de dinoflagelados en diferentes zonas, incluyendo la zona de bancos naturales o de cría de cualquier cultivo de molusco comestible. Igualmente determinar la toxina del molusco y vigilar los canales de comercialización y, por último, realizar un seguimiento de casos con sintomatología compatible con el IPM. Básicamente, la IPM fue una patología nueva hasta 1977, aunque el fenómeno de marea roja había sido señalado anteriormente como Marea Roja, Turbio o la Regla del Nar (21) por los pescadores nativos. En Venezuela, Mazparrote (16), en estudios sobre muestras tomadas de marea roja en costas nor-orientales, en los meses de junio y julio, consiguió casi exclusivamente a Exuviaella baltica y, en menor grado, el Prorocentrum micans. Señala que este fenómeno se ha observado en nuestro país en la costa norte de Venezuela, desde Punta de Araya, en la Península de Araya, hasta Punta de Mejillones, en el extremo este de la Península de Paria. El mismo autor hace referencia a Lackey, quien observó en 1956, en el Golfo de Paria. cerca de la desembocadura del Orinoco, grandes manchas rojas, señalando como causante al Gymnodinium brevis. En referencia a los factores climáticos, Mazparrote (16) resalta la relación del fenómeno con el régimen de precipitaciones. siendo máxima su floración en agosto y septiembre y, a veces, llega hasta octubre. Fernández (6) señala que fue encontrado el Noctilluca scintillans en el brote en el estado Sucre, pero no se pudo incriminar como causante del brote. En 1979 se reporta otro brote con doce casos y ninguna defunción (8) . Es lógico pensar que los factores causales varíen, ya que en la mayoría de los casos reseñados son diferentes organismos, por lo que cada uno tendrá una significación diferente según la región afectada. Entre
los años 1979-1985, no se informa sobre nuevos brotes; sin embargo,
brotes esporádicos parecen haber Aunque no relacionado con la IPM en forma directa, es conveniente señalar que, en 1982, en la Bahía de Carenero, estado Miranda, ocurrió una mortandad de peces Rabo Amarillo de talla pequeña; se observó igualmente aves marinas con signos de intoxicación. pero no se informó de manera oficial la causa de las muertes, debido a complicaciones de tipo económico-político. En esa oportunidad no se presentaron casos ni muertes por IPM. Al respecto, es oportuno reseñar a White (31), quien en 1977 refiere por vez primera sobre un dinoflagelado tóxico (complejo G. tamarensis excavata), como causante de la muerte de peces Clupea harengus harengus en la costa norte de Norte América, a través del posible vector Pterapad: Limacina retroversa (hervíboro planctónico). Igualmente, Ayres
y Culum (2). en su estudio sobre la IPM en Inglaterra. reseñan mortandad
de aves y establecen a G. tamarensis como fuente de la toxicidad observada
en moluscos. Es importante destacar que la información Por último, es de resaltar el esquema seguido por Fernández (6), quien abarca los elementos de la tríada de la enfermedad y divide las medidas de un programa de vigilancia epidemiológica de la siguiente forma:
a) Medidas sobre el medio ambiente DISCUSIÓN Y CONCLUSIONES La IPM es una enfermedad que ha venido tomando importancia a medida que aumenta la explotación y tecnología pesquera. Debido a la falta de antídoto y conocida la amplia variedad de toxinas y agentes productores, es necesario conocer los factores que condicionan su ocurrencia y distribución, para así elaborar programas de vigilancia y proponer medidas de prevención y control apropiadas Resalta como elemento del programa la determinación de toxinas en mariscos, especialmente en mejillón, e identificar los factores que favorecen el crecimiento masivo de los dinoflagelados tóxicos. Es necesario identificar las fases del ciclo de vida de los dinoflagelados, el aislamiento de la toxina parte de laboratorios especializados y el desarrollo técnica eficiente que evalúe con rapidez y precisión los niveles de toxicidad en el mejillón. En Venezuela, es preocupante la escasa información publicada acerca de la identificación y biología de los dinoflagelados, causantes del brote en 1977; más aún, hasta la fecha no se ha publicado ninguna información de los brotes subsiguientes. Otro hecho alarmante ha sido las mortandades de peces en las zonas del Litoral Central y Oriente del país. Resulta incongruente que un problema de salud pública, que lesiona vidas humanas y detiene el crecimiento de la industrialización pesquera, no sea objeto de un programa de investigación continuo que aporte datos que permitan mejorar el sistema de vigilancia que se ejecuta en la zona oriental, el cual ha limitado el problema de la IPM, a pesar de la incidencia de factores socio-económicos. Como conclusiones, se reseñan las siguientes: - Los dinoflagelados están ampliamente distribuidos, pero la IPM suele ser endémica en determinadas regiones. - La densidad de la población de dinoflagelados varía muchísimo, siendo difícil predecir su crecimiento explosivo. - Se observa la existencia de un período más peligroso en el año, presentándose a finales de verano y pudiendo durar menos de dos meses. - La presencia de marea roja no es condición necesaria ni suficiente para producir la IPM, ya que los niveles de población de dinoflagelados que pueden producir marea roja, excede a los requeridos para provocar toxicidad en los mariscos y, además, existen especies atóxicas que producen marea roja y toxicidades sin la formación de marea roja. - Se mencionan diferentes tipos de tolerancia a la toxina. - No existe un tratamiento industrial o doméstico que elimine por completo la toxicidad del marisco. - Se ha demostrado que existen diferentes tipos de toxinas causantes de la IPM. - El conocimiento de la configuración química de las toxinas, ayuda en la determinación de factores o elementos que influyan en su producción y posibles aplicaciones de tratamientos que disminuyan su absorción o produzcan su inactivación. - Los factores causales varían de acuerdo al organismo involucrado ya la región en donde se presenta la enfermedad. - Se requiere de la combinación adecuada de factores físicos y biológicos, para producir floraciones de dinoflagelados, entre ellos la estabilidad del agua hace posible el aporte de nutrientes, y la temperatura del agua y la radiación solar son factores causales importantes. - Los mecanismos de desintoxicación natural varían de acuerdo a la especie de marisco involucrado. - El conocimiento del papel de la forma quística (bentónica) en el mantenimiento de toxicidad de dinoflagelados es de urgente investigación. - La posibilidad de que poblaciones de quistes de G. tamarensis en el sedimento, sea una fuente continua de toxicidad. parece ser la base de explicación de la aparición de toxicidad sin floración de dinoflagelados. - Los sistemas de vigilancia a través de muestreo y detección de niveles tóxicos en mariscos. demuestran ser efectivos. - Se presenta un modelo epidemiológico que permite identificar factores que inciden sobre los elementos de la tríada de la IPM. - Es necesario alertar a la población humana sometida a riesgo, destacándose la educación sanitaria que promueva un cambio de actitud de la población, manteniéndola vigilante ante cualquier indicio de la enfermedad y que conozca los peligros inherentes al consumo de mariscos tóxicos. BIBLIOGRAFÍA 1. ANDERSON, D.M. y F.M.M. MOREL. 1979. The seeding of two red tide blooms by the germination of benthic Gonyaulax tamarensis Hypnocyst. Estuarine and Coastal Marine Science (8) :279-293. 2. AYRES, P.A. y M. CULLUM, 1978. Paralytic shellfish poisoning. An account of investigations into mussel toxicity in England 1968-77. Fisheries Research Technical Report N° 40. Ministery of Agriculture Fisheries and food. 23 p. 3.BAGNIS. R., F. BERGLUND, P.S. ELIAS. G. VAN ESCH, B.W. HALSTEAD y K. KOJIULA. 1970. Problems of toxicants in marine food products. 1. Marine biotoxins. Bull.Wld. Hlth. Org. (42) :69-88. 4.BURDASPAL, p.. 1984. Revisión de la situación actual en la determinación analítica de la toxina paralizante de los moluscos (PSP). Trabajo presentado en las IV Jornadas Técnicas "Ostra". Pontevedra, España. 5.CURSO INTERFACULTADES DE POSTGRADO EN CIENCIA Y TECNOLOGIA DE ALIMENTOS. Avances en procesamiento de productos pesqueros. Material bibliográfico. Caracas, Universidad Central de Venezuela. 1985. pag. var. 6. FERNANDEZ, R.. 1977. Descripción de las intoxicaciones producidas por consumo de mejillones (Pernaperna) (Río Caribe, estado Sucre). 15 p. mimeo. 7. FERNANDEZ. R.. 1978. Intoxicación por moluscos en el Oriente del país. Boletín de Salud Pública N° 31, Año XI. (Caracas, Venezuela). p. 5-12.dola vigilante ante cualquier indicio de la enfermedad 8.HALSTEAD. B.W. y E.J. SCHANTZ. 1984. Intoxicación paralítica por moluscos. Organización Mundial de la Salud. Publicación en Offset. N° 79. 59 p. 9.JAMIESON. G.S. y R.A. CHANDLER. 1983. Paralytic shellfish poison in sea scallops (Placopecten magellanicus) in the west atlantic. Can.P.Fish. Aquat.Sci. 40 :313-318. 10.KAT. M.J., J. SPEUR y P.F. OTTE. 1982. Diarrhetic musselpoisoning in The Netherlands related to the ocurrence of Dinophysis acuminata. September- October 1981. International Council for the Exploration of the sea and C.M. 1982/E :24 Marine Environmental Quality Comittee. 13 p. 11.KAT. M.. 1983 .Diarrhetic mussel poisoning in The Netherlands related to the dinoflagelle Dinophysis acuminata. Antonie van Leeuwenhoek. 49:417-427. 12. KAT. M.. 1983.Dinophysis acuminata blooms in the Duth coastal area related to diarhetic mussel poisoning in the Duth Waddensea. Sarfia 68 :81- -84. 13. LILIENFELD. M.D. y D. LILIENFELD. 1983. Fundamentos de epidemiología. Fondo Educativo Interamericano pp. 39-54. 172-196. 14. LOPEZ CAPONT. F. 1978. La toxina del mejillón y otros moluscos. Su problemática e importancia para España. Rev. de Agro-Química y Tecnología de Alimentos 18(1) :47-63. 15. MAC MAHON. S. y T. PUGH. 1970. Epidemiology. Principles and methods. Boston. Little. Brown and Company. pp. 17-72. 16. MAZPARROTE. S.. 1967. Observaciones preliminares sobre la composición y aspectos del " turbio" o marea roja en las costas orientales de Venezuela. Memoria de la Sociedad de Ciencias Naturales la Salle. Venezuela. Tomo XXVII. N° 76:37-45. 17. MEDCORF, J.C., A.H. LEIM, A.B. NEEDLER y A.W.H. NEEDLER. 1947. Paralytic shellfish poisoning on the Canadian Atlantic Coast. Bull.Fish.Res.Bd. Can. LXXV. 32 p. 18. MIRA GUTIERREZ, J., 1970. Ictiosarcotoxismo: un riesgo médico y sanitario de la fauna marítima. Rev. San. e Hig. Pub. (España) 4 :460-515. 19. ODUM, E.. 1972. Ecología. 3a. ed. Interamericana p. 368. 20. ORGANIZACIÓN MUNDIAL DE LA SALUD. 1975. Higiene del pescado y de los mariscos. Serie de Informes Técnicos N° 550. Ginebra. 21. PACHECO TROCONIZ, G. y G. TORO ALAYON. 1978. La marea roja y el problema de la toxina paralizante de los moluscos. Boletín de Salud Pública N° 31. Año XI (Caracas, Venezuela). pp. 13-16. 22. PRAKASH, A. 1967. Growth and toxicity of a merine dinoflagellate, Gonyaulax tamarensis. J.Fish.Res. Bd., Canada. 24(7) :1589-1606. 23.REICHARDT, P.B., R.A. NEVE, R.M. GERSHEY, S. HALL, D.L. MUSGRAVE, P.I. SEATON y G.A. SWISHER, Jr., 1982. Chemical investigations of paralytic shellfish poisoning in Alaska. Trabajo presentado en las Primeras Jornadas Técnicas Moluscos Gallegos: Mejillón. Santiago de Compostela. Asociación de Científicos y Tecnólogos de Alimentos de Galicia. 49 p. 24. REPUBLICA DE VENEZUELA. MINISTERIO DE SANIDAD Y ASISTENCIA SOCIAL. División de Epidemiología. 1977. Brote de intoxicación alimentaría en la población de Manzanillo del estado Nueva Esparta. Boletín Epidemiológico Semanal N° 18. (Caracas, Venezuela). 25.
REPUBLICA DE VENEZUELA. MINISTERIO DE SANIDAD Y ASISTENCIA SOCIAL.
División de Epidemiología. 1977. intoxicación por mejillones en el
estado Sucre. Boletín Epidemiológico Semanal N° 31 (Caracas, 26.
REPUBLICA DE VENEZUELA. MINISTERIO DE SANIDAD Y ASISTENCIA SOCIAL.
División de Higiene de los Alimentos. 1977, informe sobre muestreo de
mejillones y agua en zonas de cultivo artificial y bancos 27. SCHANTZ, E.J. 1960. Biochemical studies on paralytic shellfish poisons. Ann.N.Y. Acad.Sci. 90(Art.3): 843-855. 28. SHIMIZU, Y.. 1979. Development in the study of paralytic shellfish toxins. In: Taylor y Seliger (eds.), Toxic dinoflagellate blooms. North Holland Elseiver inc. pp. 321-328. 29. TAYLOR, F.J.R., 1968. Parasitism of the toxinproducing dinoflagellate Gonyaulax catenella by endoparasitic dinoflagellate Amoebophrya ceratii. J. Fish. Res. Bd. Canada 225(10) :2441-2445. 30. U.S.A. FOOD AND DRUG ADMINISTRATION. 1984. Proceeding of the second national conference for food protection. Washington D,C. pp. 141-143. 31. WHITE, A.. 1977. Dinoflagellate toxins as probable cause of an attlantic herring (Clupea harengus harengus) kill, and pteropods as apparent vector. J.Fish Res. Board Can. (34) :2421-2424. 32.
YON-YEN,
L., M. RISK, S.M. RAY, D. VAN ENGEN, J. CLARDY, J. GOLIK, J.C. JAMES y K.
NAHANISHI, isolation and structure of brevetoxin B from the "Red Tide"
dinoflagellate Ptychodiscus brevis (Gymnodinidium
breve). J, Am.Chem.Soc. (103) . |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||