|
SINTOMAS DE DEFICIENCIA DE BORO Y PRODUCCION
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
RESUMENP. C. : Boro en el tejido, micronutrimento, Sesamun indicum L. INTRODUCCIONEl área de producción tradicional de ajonjolí en Venezuela, está localizada en la región de Turén, Edo. Portuguesa, en suelos de textura franco arcillosa o arcillosa, con una alta capacidad de retención de agua y a veces con mal drenaje. El ajonjolí ocupa un lugar secundario en la rotación con el maíz, debido a que se siembra al cosechar este cereal, al finalizar la época de lluvia, aprovechando el ajonjolí la humedad residual del suelo para crecer y madurar. En 1984 se estableció la explotación del ajonjolí en los estados Anzoátegui y Monagas, en suelos franco arenosos o arenosos, de baja fertilidad, pobres en materia orgánica y ácidos. En 1985 el cultivo mostró anormalidades en su desarrollo: hojas gruesas con signos de clorosis intervenal y curvadas hacia abajo; tallos torcidos y aborto de las flores y frutos y, finalmente, necrosis, todo lo cual ocasionó grandes pérdidas y consecuentemente la desaparición del cultivo en la región. Este fenómeno pudo ocurrir, en parte, por deficiencias de boro. Los síntomas visuales de deficiencias de boro son inicialmente más visibles en las porciones apicales de la planta, por la baja movilización de este elemento (AGARWALA et al., 1981; AMARAL et al., 1983; CRESPO et al., 1979; DIBLE y BERGER, 1952; GUPTA, 1979; REDINGTON y PETERSON, 1983). En el caso del maíz se observan hojas con bandas transparentes que luego se tornan blancas; en las especies leguminosas forrajeras se aprecian hojas con moteado blanquecino que luego pasan a amarillas. La deficiencia de boro también produce un acortamiento de los entrenudos apicales ocasionando un aspecto de abundancia de hojas en forma de rosetas (CRESPO et al., 1979; GUPTA, 1979; Mac QUARRIE et al., 1983). Las hojas muchas veces presentan una textura gruesa, aspera, arrugadas y de apariencia frágil, encorvadas hacia abajo y muerte de la yema terminal (FORNO et al., 1979; GUPTA, 1979; HARBAUGH, 1986; MAGALHAES y MONNERAT, 1978; PEREZ y CHILDERS, 1980; REDINGTON y PETERSON, 1983). La formación de semilla también es fuertemente afectada por la deficiencia del boro; en el caso del maíz la floración puede ser inhibida por presentarse necorosis de las espiguillas, disminución de la capacidad de producción de polen y poco desarrollo del tubo polínico (AGARWALA et al., 1981), lo que conduce a la producción de mazorcas mal formadas, pequeñas y con pocos granos (MOZAFAR, 1987); resultados parecidos han sido encontrados en arroz, donde se observó aborto de flores y baja viabilidad del polen (GARG et al., 1979). El objetivo de este trabajo fue conocer el desarrollo de las deficiencias de boro en el ajonjolí cuando este elemento es suprimido parcial o totalmente en la solución nutritiva, durante las diferentes etapas del desarrollo de la planta. MATERIALES Y METODOSLas deficiencias de boro se estudiaron en un experimento con soluciones nutritivas Hoagland 2, en las que el Fe se aplicó en forma quelatada (Fe-EDTA) a razón de 2 mg/l de solución nutritiva. La interrupción o la reducción del suministro de B se hizo a partir de los 20 días después de la siembra, fase vegetativa (V); a los 30 días, inicio de la fase de floración (f) y a los 40 días, inicio de la fructificación (F). En todos los tratamientos se aplicaron 0.5 mg B/l, en forma de ácido bórico, al inicio de experimento hasta el momento de interrupción o reducción de la dosis. Con este criterio se formaron siete tratamientos: testigo (T) 0.50 mg B/l durante todo el ciclo; 0.0 mg B a los 20 días (0.0 V); 0.25 mg B a los 20 días (0.25 V); 0.0 mg B a los 30 días (0.0 f); 0.25 mg B a los 30 días (0.25 f); 0.0 mg B a los 40 días (0.0 F) y 0.25 mg B a los 40 días (0.25 F). El pH de las soluciones nutritivas se ajustó a 4.8 con Na (OH) 0.01N al inicio del experimento y periódicamente cuando fue necesario. Se usaron potes de plástico de 5 l de capacidad y en cada uno se colocaron 4 litros de la solución nutritiva. Cada pote se tapó con una lámina de anime con nueve perforaciones de 1 cm de diámetro, en cada ocho de ellas se colocó una plántula de ajonjolí, variedad Aceitera 86-499, previamente germinada en papel absorbente con agua destilada, con 5 cm de longitud radical. Cada planta fue sostenida con goma espuma, garantizando que las raíces hicieran contacto con la solución nutritiva. A los 10 días se eliminaron cuatro plantas, dejando las más uniformes. En el noveno orificio de la lámina de anime se colocó un tubo de vidrio conectado a un compresor, con trampa de agua para filtrar el aire, con la finalidad de aerear las soluciones cuatro veces por día por espacio de 30 minutos. Las soluciones se cambiaron cada 10 días durante los 95 días el ciclo del cultivo, y el nivel de ellas se mantuvo con agua destilada, cuando fue necesario. Los potes se distribuyeron en un diseño completamente aleatorizado con tres repeticiones, en un invernadero enfriado con cortina de agua, donde la temperatura diurna promedio fue 28.8ºC y la nocturna 22.1ºC. Las plantas se cosecharon al cumplir 95 días y se separaron raíz, tallo, hojas y frutos los cuales fueron lavados con agua destilada y secados en una estufa de ventilación forzada por 48 horas a 70ºC, para determinar el peso de la materia seca (MS) de la parte vegetativa y de la semilla. El material vegetal se molió y tamizó en una malla de 1 mm. Para la determinación de B se pesó 0.5 g de muestra y se digirió en seco (POWELL y ALLEN, 1979); el desarrollo de color se hizo por medio de la Azometina-H (POWELL y ALLEN, 1979; WOLF, 1971). RESULTADOS Y DISCUSIONEl primer síntoma de la deficiencia de B que se registró en el tratamiento 0.0 V fue una clorosis en la base de las hojas apicales que abarcó la lámina y nervadura, la cual se fue intensificando con el tiempo. A los 12 días las hojas del tercio medio tomaron una textura gruesa, áspera y coriácea, los bordes se doblaron hacia abajo, posiblemente debido a una menor elongación de las nervaduras con respecto a la lámina; 5 días más tarde estos síntomas se manifestaron en las hojas superiores así como en las basales (Figura 1). En los tallos aparecieron manchas necróticas y las flores formadas no se abrieron. Las raíces mostraron poco desarrollo y tenían las puntas necrosadas.
En 0.25 V se encontraron los mismos signos de clorosis, forma y textura de las hojas que en 0.0 V. En el tallo se detectaron manchas cloróticas pequeñas. A los 16 días de la reducción del B se activaron las yemas axilares y dieron origen a brotes laterales en el tercio superior; con el tiempo este fenómeno se extendió al tercio medio e inferior. A los 7 días se inició una defoliación de las hojas inferiores. A los 60 días se registró una necrosis en las hojas superiores (Figura 2). Las raíces mostraron color oscuro en toda la superficie.
Después de ocho días de la supresión del B en 0.0 f, el crecimiento de las plantas fue menor o se detuvo y aparecieron los síntomas de clorosis, forma y textura en las hojas superiores, lo cual se extendió, con el tiempo, a las del tercio medio e inferior. En los primordios apicales se encontraron síntomas de necrosis y los ápices de las plantas se doblaron hacia abajo (Figura 3). En los bordes de las hojas inferiores aparecieron manchas necróticas y se inició una defoliación. La floración fue reducida y se formaron pocos frutos, el tallo tomó un color púrpura.
La supresión parcial del B en la floración (0.25 f) mostró la misma sintomatología de 0.0 f, pero con menor intensidad; raíces oscuras, defoliación casi total de las hojas basales y medias quedando sólo las hojas apicales con manchas necróticas, hacia el final del ciclo. A los 81 días se observaron brotes de las yemas del tercio inferior y tallos de coloración oscura. En 0.0 F se presentaron manchas cloróticas en las hojas del tercio inferior y una leve defoliación al final del ciclo, en cambio en 0.25 F no se notaron signos de deficiencia. La producción de materia seca del vástago y raíces fue significativamente afectada por la supresión total del B en cualquiera de los tres estadios de desarrollo de la planta (Cuadro 1). En la medida que dicha eliminación fue más temprana, el efecto sobre la formación de la MS fue mayor. El órgano más afectado por la supresión total o parcial de B fue la cápsula. En 0.0 V no se formaron cápsulas y en 0.0 f la MS de las cápsulas se redujo en 9.8 veces con respecto a T, esto es posiblemente debido al efecto del B sobre la polinización, la cual se ve afectada cuando hay deficiencia de este elemento (BERGER et al., 1957; GARG et al., 1979; MAGALHAES y MONNERAT, 1978). Cuando la supresión de B se redujo a la mitad de cantidad usada en el testigo, no se encontró disminución de la materia seca de ningún órgano vegetativo de los tratamientos 0.25 V y 0.25 F; en cambio, en 0.25 f la MS formada fue significativamente inferior a la de T. El comportamiento de la planta en 0.25 V y 0.25 F se podría explicar por el hecho de que la planta de ajonjolí tenía una reserva adecuada de B al momento de la reducción de la dosis, y que esta cantidad fue suficiente para mantener el aparato vegetativo; sin embargo, este criterio no explica lo sucedido en 0.25 f, donde la baja en MS se podría atribuir a que la deficiencia de B ocurrió en una etapa altamente crítica para la planta, inicio de floración, donde el requerimiento o distribución del B pudieron afectar el proceso de polinización y fecundación de acuerdo a lo publicado por otros autores (BERGER et al., 1957; GARG et al., 1979 MAGALHAES y MONNERAT, 1978).
La MS de las raíces siguió el mismo patrón que en el del vástago. La supresión de la mitad del B en V y F no afectó el desarrollo radical, en cambio, en f la MS radical se redujo en 44%, este comportamiento pudo afectar la absorción de nutrimentos, disminuyendo la capacidad de formar materia seca en la parte aérea (LEAF, 1953). Cuando se suprimió totalmente el B en V la reducción en MS alcanzó al 91%, en f a 75% y en F a 38.14%. La producción de semilla en T, con 0.5 mg B/l, alcanzó a 17.33 g/pote. La eliminación del B o su reducción a 0.25 mg/l ocasionó una drástica reducción en el peso de la semilla (Cuadro 1). Las etapas más críticas del ajonjolí, con respecto a la deficiencia de B, fueron V y f, en las que la reducción en el peso de la semilla varió entre el 100 y el 62.0%; en cambio, la deficiencia de B en F ocasionó una disminución del peso de la semilla entre 26.1 y 17.3%. La fuerte reducción en la producción de semilla pudiera atribuirse a la disminución de la floración. Otros autores (AGARWALA, et al., 1981; BERGER et al., 1957; CRESPO et al., 1979; GARG et al., 1979) han encontrado que la deficiencia de B afecta la floración, la capacidad de producción de polen viable y su desarrollo en el proceso de la fecundación, lo que incide negativamente en la formación de semilla. El llenado de la semilla fue altamente afectado por la deficiencia de B (Cuadro 2). La deficiencia temprana en V y f ocasionó la mayor disminución de la densidad del grano, lo cual tuvo una alta influencia sobre la producción de semilla por pote. En cambio, la deficiencia de B estimuló la formación de semilla, llegando a ser el número de estas 0.22 a 1.38 veces mayor que la del testigo. Este comportamiento indica que la deficiencia de B no afectó la viabilidad del polen ni la fecundación y que, por el contrario, hubo un estímulo a la formación de mayor número de semillas, pero con baja densidad. Estos datos contradicen lo indicado por MOZAFAR (1987) quién encontró que al suprimir el B, desde una semana antes de la emergencia de la panoja del maíz hasta la madurez, se interrumpió el desarrollo normal de la mazorca y de los granos. La producción de semilla por el ajonjolí demuestra que la provisión adecuada de B debe ser contínua durante el ciclo, ya que su interrupción parcial, aun en la época del inicio de la formación de cápsulas, ocasiona una caida significativa del peso de la misma. La distribución del B en las partes del vástago del ajonjolí, en condiciones de buena suplencia del testigo, mostró una mayor concentración en las hojas 235 mg/g, esto es 3 veces más que en las cápsulas y 9.7 veces más que en el tallo (Cuadro 3). La supresión total o parcial del B ocasionó una disminución significativa de este micronutrimento en las hojas, tallos y cápsulas de la planta, independientemente de la época de inicio de la restricción, con excepción para las hojas del tratamiento 0.25 F donde el nivel del B fue de 256 mg/g, valor estadísticamente igual al testigo. Esto significa que la disminución del B disponible en un 50%, al inicio de la aparición de las cápsulas, fue suficiente para mantener la suplencia para las hojas y que la planta, en esta etapa de su desarrollo, tiende a acumular más boro en las hojas, que en los tallos y cápsulas. La distribución del B, en las plantas donde la restricción fue hecha en V o f, mostró un comportamiento diferente a T, el B en la hoja fue aproximadamente igual al encontrado en las cápsulas, evidenciando una tendencia a transportar el B hacia la cápsula en mayor proporción que cuando la suplencia de este micronutrimento es normal. La correlación encontrada entre el B de la hoja y el de la cápsula fue alta con un coeficiente R de 0.70 para P <=0.08.
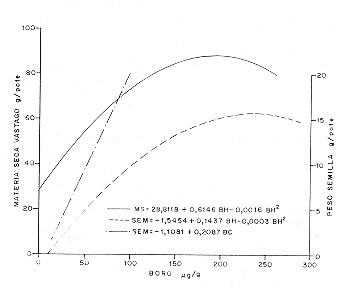
Para conocer la importancia de la concentración de B en las hojas (BH) y en la cápsula (BC), sobre la producción de MS y semilla, los datos obtenidos se ajustaron con ecuaciones lineales y polinomiales de segundo orden, para luego escoger aquellas de mejor ajuste por medio de la comparación de los coeficientes de correlación. El mejor ajuste de la MS y BH se encontró con la ecuación polinomial, donde el coeficiente R2 fue de 0.51 (Figura 4), que indica que se podría atribuir al BH el 51% de la formación de la MS, bajo las condiciones del experimento. La producción de semilla y el BH también mostró un mejor ajuste con la ecuación polinomial, con un coeficiente de determinación (R2) de 0.97.
La pendiente de la ecuación MS-BH, en la fracción lineal, fue 0.6146 el cual es más alto que la correspondiente al de la ecuación semilla-BH de 0.1427. Sin embargo, la dependencia de la semilla del BH es mayor, ya que el coeficiente de determinación para esta relación es más alto, casi el doble. Este comportamiento demuestra que la producción de la semilla está más influenciada que la materia seca del vástago, por la concentración del boro en las hojas. La producción de semilla no solamente dependió, en una alta medida, del BH, sino también del BC, esta última relación fue de carácter lineal con un coeficiente de determinación de 0.72 (Figura 4). Un buen transporte de B de las hojas hacia las cápsulas parece ser una condición indispensable para la formación y aumento de peso de la semilla. La concentración del BH y el BC mostró una alta correlación positiva con un coeficiente R=0.70, para un nivel de probabilidad para P.08. Esto demuestra que en la medida que se enriquece la concentración de BH hay un transporte eficiente que provee el B requerido en la cápsula, que tiene una alta influencia para la producción de semilla, que ha sido demostrado por la relación lineal existente (Figura 4). SUMMARYKey Words: Boron in the tissue, micronutrient, Sesamun indicum.
BIBLIOGRAFIAAGARWALA, S., P. SHARMA, C. CHATTERJEE and C. SHARMA. 1981. Development of enzimatic changes during pollen development in boron deficient maize plants. J. Plant Nutr. 3:329-336. AMARAL, W. Do., J.R. SARRUGE e G.J. SFREDO. 1983. Deficiencias de macronutrientes e de Boro en Seringueira Hevea brasiliensis L. Anais da E.S.A. Luiz de Quiroz. 40:527-552. BERGER, K.C., T. HEJKKJNEN and E. SUBE. 1957. Boron deficiency a cause of blank stalks and barren ear in corn Soil Sci. An. Proc. 21:629. CRESPO, G., J. ASPIOLEA y M. LOPEZ. 1979. Nutrición de pastos In: Los pastos en Cuba, Ed. Instituto de Ciencia Animal. pp 237-287, La Habana, Cuba. DIBLE, W. T. and K.C. BERGER. 1952. Boron content of alfalfa as influence by boron supply. Soil. Sci. Soc. Am. Proc. 16:60-62. FORNO, D., C. ASHER and D. EDWARDS. 1979. Boron nutrition of casava and the boron x temperature interaction. Field Crops Research. 2:265-279. GARG, O., A. SHARMA and G. KONA. 1979. Effect of boron on the pollen vitality and yield of rice plants Oriza sativa L. var Java. Plant and Soil. 52:591-594. GUPTA, U. 1979. Boron in soils and plants. Comm. in Soil Sci. and Plant Analysis 3:355-365. HARBAUGH, B. 1986. Visual nutrient deficiency symptoms in Caladium hortulanum Birdsey. J. Am. Soc. Hort. Sci. 111:248-253. LEAF, G.L. 1953. Boron in relation to water balance in plants Proc. Iowa Acad. Sci. 60:179-91. Mac QUARRIE, J., W. SACKSTON and B. COULMAN. 1983. Suspected boron deficiency in birdsfoot trefoil in field plots. Canadian Plant Deseases Survey. 63:23-24. MAGALHAES, J. e P. MONNERAT. 1978. Aplicacao foliar de boro na prevencao de deficiencia e na composicao mineral do tomateiro. Pesquisa Agropecuaria Brasilera 13:81-89. MOZAFAR, A. 1987. Effect of Boron on ear formation and yield components of two maize Zea mays L. hybrids. J. of Plant Nutrition 10:319-332. PEREZ, A. and N. CHILDERS. 1980. Growth, yield and nutrient content and fruit quality of Carica papaya L. under controlled conditions. II. Boron effects. J. Agri. Unv. Puerto Rico. 80-89. POWEL, J. and M. ALLEN. 1979. Boron determination in plant tissue by the azometine-H method. Comm. in Soil Sci. and Plant Analysis 10:1099-1108. REDINGTON, C. and J. PETERSON. 1983. Influence of boron on bud blasting ant plant growth in Zinnia elegans. Bull. Torrey Botanical Club 110:77-79. WOLF, B. 1971. The determination of boron in soil extracts, plant materials, compost, manures, water and nutrient solutions. Soils Sci. and Plant Analysis 2:363-374. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||