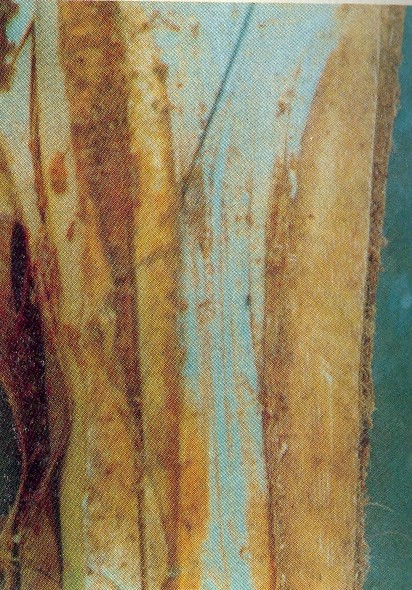|
Agronomía Tropical. 32(1-6): 291-302. 1982 MARCHITEZ
DEL COCOTERO ASOCIADA José M. Barreto * * Fondo
para el Desarrollo del Coco, de la Copra Recibido: Enero 24, 1983. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
INTRODUCCION Los antecedentes sobre la presencia de protozoarios flagelados en las plantas se remonta al año 1909, cuando LAFONT (9) los encuentra en el latex de Euphorbia pilulifera. Posteriormente STAHEL (15), en Surinam, observó protozoarios ocasionando necrosis en el floema de plantas de café (Coffea liberica). En 1976, fue señalada por primera vez desde Surinam una marchitez del cocotero asociada con protozoarios flagelados. En ese país, PARTHASARATHY, VAN SLOBBE y SOUDANT (13) encontraron protozoarios en los conductos floemáticos de cocoteros afectados por la enfermcdad "Hart-rot". DOLLET y LOPEZ (12), trabajando con muestras de palma de aceite (Eleais guinensis) enfermas, procedentes del Perú, Colombia, Ecuador y Surinam, hallaron una relación específica entre marchitez y protozoarios flagelados. DOLLET et al. (3), en 1979, encontraron que en la Costa Occidental del Ecuador había cocoteros padeciendo de marchitamientos parecidos a los de "Anillo rojo", pero que en el 80 % de los casos era un problema de protozoarios flagelados. GRIFFITH (5,6,7,8) y WATERS (17) en Trinidad, informan de una marchitez atacando cocoteros, principalmente en la Península de Cedros, señalando la asociación entre la enfermedad "Cedros wilt" y protozoarios flagelados. En
Venezuela, investigando una marchitez en cocoteros que presentaban síntomas
semejantes a los debidos a la enfermedad "Anillo rojo", se
encontró que en el 90 % de los casos estaban presentes organismos
protozoarios flagelados. En este trabajo se presentan las
investigaciones preliminares acerca de la enfermedad, siendo la
primera información sobre este tópico reportada
en nuestro país. MATERIALES
Y METODOS En diferentes fincas de las poblaciones de Irapa, Yaguaraparo y Güiria de la Península de Paria, en el Estado Sucre, se tomaron muestras de raíces, inflorescencias, raquis de las hojas, estípite y de la zona del punto de crecimiento de 50 cocoteros que mostraban síntomas de marchitamiento. Se tomaron secciones de tejidos previamente desinfectados y presionándolos con una pinza (alicate), se extrajeron gotas de savia de los diferentes órganos del cocotero. De igual manera se hizo con muestras de cocoteros aparentemente sanos. La savia extraída de los tejidos fue puesta en gotas sobre láminas porta-objetos y con cubre-objetos se observaron al microscopio (10 x y 40 x). Para la coloración de los flagelados se utilizó el método de Giemsa, haciendo frotis de savia sobre láminas porta-objetos desgrasadas. dejándolas secar al aire. Las láminas secas fueron colocadas durante 5 min dentro de cápsulas de Petri conteniendo metanol absoluto. A las 24 horas se hizo la coloración, preparando 20 ml de solución Sorensen pH 7,2 y 8 gotas de colorante Giemsa. Con el colorante así preparado se cubrió toda la lámina por un tiempo de 30 min, transcurrido este tiempo se lavó con agua de chorro, dejándose secar; consecuentemente los flagelados fueron observados al microscopio (40 x). Se recolectaron malezas en los alrededores de los cocoteros con síntomas de marchitez, seleccionando aquellas de condición laticífera y se les extrajo gotas de latex de diferentes órganos, las cuales fueron colocadas sobre una gota de agua estéril, haciéndose un extendido sobre una lámina porta-objetos, procediendo a su fijación y coloración al igual que para el caso de la savia de cocoteros. Los insectos se recolectaron sobre las hojas de las malezas y fueron llevados al laboratorio donde se colocaron en el refrigerador por 10 min; después les fueron cortadas las antenas, patas y alas, desinfectándose con Clorox 0,85 % durante 1 min; posteriormente se pasaron 2 veces por agua destilada estéril durante 1 min y por último se hizo un macerado. De este último se' hizo un frotis y se coloreó con Giemsa. La
medición de los flagelados se hizo sobre 20 organismos, ya fijados, de
varios órganos y de diferentes plantas, utilizando un micrómetro
ocular con objetivo 40 x, midiéndose el largo y ancho del cuerpo y el
largo del flagelo. A
cada 20 mediciones se calculó la media y la desviación típica. RESULTADOS Sintomatología de la Enfermedad. En general, los cocoteros afectados por esta marchitez fueron plantas adultas en producción. Los primeros síntomas se observaron en las hojas mas viejas o inferiores, las cuales presentaban un amarillamiento progresivo desde el ápice hacia la base y finalmente se tomaron de un color marrón café (Fig. 1). Estas hojas se quiebran por el raquis, se desprenden o pueden quedar colgando arropando al estípite. A medida que progresa la enfermedad, el amarillamiento alcanza a las hojas de la corona, éstas se marchitan y se quiebran por el pecíolo. La caida de los frutos se produce en cualquier etapa del desarrollo de los mismos y los más jóvenes a veces presentan necrosis en el endosperma y se desprenden dejando las brácteas pegadas a las inflorescencias. Estas sufren necrosamiento, que comienza por la base del raquis y la punta de los raquídios y en estado avanzado de la enfermedad se necrosan totalmente (Figuras 2 y 3). Las raices se van necrosando .desde la corteza hasta alcanzar la parte central (Fig. 4). Al
realizar un corte transversal cerca de la base del .estípite, el tejido
no muestra a simple vista decoloración (Fig. 5.), pero la zona del estípite
que corresponde al punto de crecimiento (Fig. 6), presenta una pudrición
que al inicio tiene olor fétido y posteriormente causa la caida del
cogollo. Todo este proceso dura entre 45 - 60 días siendo más rápido
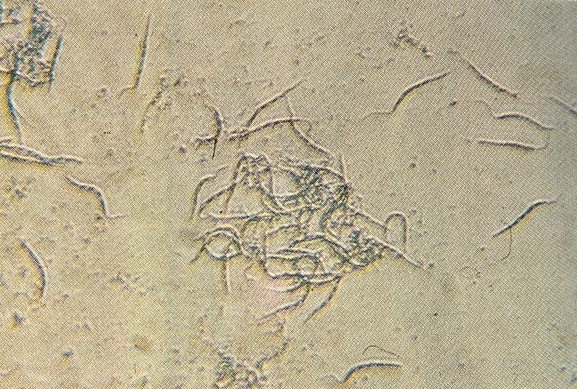
en plantas jóvenes comenzando a producir. Protozoarios observados. En las gotas de savia extraídas de las muestras de cocoteros con síntomas de marchitez, se observó gran cantidad de organismos protozoarios uniflagelados (Fig. 7) de unos 13,6 - 17,7µ de largo y de 1,6 - 2,1 µ de ancho. Los protozoarios están presentes en las etapas iniciales de la enfermedad y los sitios de la planta donde están más frecuentes y en mayor número son: raices, estipite, inflorescencia, raquis de las hojas jóvenes y la zona del punto de crecimiento. Los flagelados en estos órganos son semejantes, sin embargo en la mayoría de las plantas los protozoarios de las raices son de mayor longitud (Cuadro 1). Análisis de malezas. En el estudio de las malezas más comunes en las fincas cocoteras que presentaban plantas enfermas por marchitez, se encontró que tres especies de Euphorbiaceae (Euphorbia hirta, Euphorbia hypericifolia y Euphorbia sp) y una especie de Asclepiadaceae (Asclepias curassavica) presentaban protozoarios flagelados (Cuadro 2). Se observó que en el latex de la maleza Asclepias curassavica (Fig. 8) el número de protozoarios era muy superior al resto de las malezas analizadas.
Análisis de insectos. De los insectos capturados sobre malezas de las cercanías de los cocoteros con síntomas de marchitez, se pudo observar la presencia de los siguientes insectos (Fueron identificados en el laboratorio de Entimología de la Facultad de Agronomía U.C.V. Maracay, por E. Osuna.): Oncopeltus semilimbatus (Fig. 9), Pachybrachius bilobatus, Plapigus patellatus, chariesterus armatus, aphis nerii.
En
Oncopeltus semilimbatus se encontraron protozoarios flagelados caracterizados
por un color híalino, con o sin torciones y con flagelo muy grande,
igual o superior al largo del cuerpo y de gran movilidad. Los demas
insectos también resultaron ser portadores de protozoarios. DISCUSION De acuerdo con los resultados de este trabajo se infiere que la marchitez observada sobre cocotero en la Península de Paria es similar a la señalada en Surinam, Colombia, Trinidad, Ecuador y Perú. La sintomatología observada coincide con la descrita por otros autores (ll, 12, 13, 17) los cuales describen la enfermedad en plantas jóvenes y adultas; sin embargo, en la zona en estudio se encontró la enfermedad atacando sólo plantas en producción, lo cual indica que el punto de inicio de la infección es la inflorescencia y el vector un hemiptero u homóptero asociado a malezas laticíferas, el cual ocasionalmente se moviliza hacia las flores del cocotero. La presencia de flagelados en las plantas enfermas y su ausencia en las plantas sanas revela que estos organismos son seguramente la causa de la enfermedad; sin embargo son necesarias las pruebas de patogenicidad del organismo para confirmarlo definitivamente. Las
mediciones en micras ( µ ) hechas por diversos autores (11, 12, 13)
concuerdan con las obtenidas en este trabajo, por lo que podría
afirmarse que se trata de la misma especie de protozoarios observados en
Venezuela. (Cuadro
3).
Mc GHEE y Mc GHEE (12), en un estudio sobre plantas hospederas, observaron que las Asclepiadiaceae hospedan Phytomonas elmassiani, las Euphorbiaceae Phytomonas davidi y el cocotero es huesped de Phytomonas staheli. Sin embargo, en este estudio se encontró que los insectos Pachybrachius bilobatus, Oncopeltus semilimbatus, Plapigus patellatus, Chariesterus armatus y Aphis nerii hospedan Phytomonas que en muchos casos se asemejan en color, forma y tamaño al flagelado observado en cocotero, aunque también se encuentran en estos insectos (Oncopeltus semilimbatus y Aphis nerii) protozoarios con torciones, semejantes a Phytomonas elmassiani, lo cual podría sugerir que el Phytomonas de algunos de estos insectos fuera inoculado al cocotero y en el floema sufriera alguna modificación en relación a su tamaño y longitud del flagelo. Al respecto, McCOY (11) señala la posibilidad de la existencia de diferentes razas de Phytomonas stabeli capaces de producir diferentes síntomas y la presencia de distintos vectores, principalmente del orden Homóptera, que pueden transmitir el flagelado de diferentes plantas hospederas. GRIFFITH (8) señala que el insecto hemiptero de la familia Pentatomidae Mecistorbinus picea puede transmitir el flagelado de cocotero infectado a cocotero sano. Sin embargo, este insecto no ha sido encontrado en cocoteros de la zona estudiada. Nuevas
investigaciones deberán enforcarse hacia el estudio tanto de insectos
como de plantas hospederas de Phytomonas y establecer su relación con
el cocotero. CONCLUSIONES Los resultados de este trabajo indican que en las fincas cocoteras de la Península de Paria, en el Estado Sucre, se encuentran plantas afectadas por un marchitamiento y muerte sorpresiva, la cual está asociada a la presencia de 0IVanismos protozoarios flagelados. Estos se encuentran en las etapas iniciales de la enfermedad, y se circunscriben en los conductos floematicos de diferentes órganos de la planta, no estando presentes en plantas sanas o en plantas afectadas por "Anillo rojo". La sintomatología es parecida a la descrita en Colombia, Surinam y Trinidad para la enfermedad "Marchitez", "Hart-rot" y "Cedros wilt" estando siempre asociada a Phytomonas sp. Los resultados obtenidos evidencian la posibilidad de que estos organismos sean la causa de la enfermedad, aunque su patogenicidad no ha sido probada. Por esta razón, es recomendable que investigaciones posteriores sean dirigidas hacias las inoculaciones de savia con flagelados, tomadas directamente de cocoteros enfermos o a través de transmisión por insectos asociados al cocotero y a las malezas laticíferas, portadoras de Phytomonas sp. AGRADECIMIENTO El
autor expresa su agradecimiento al Dr. Reginald Griffith, fitopatólogo
de Red Ring Research de Trinidad, por su información sobre el tema. A
los fitopatólogos Zoraida Suárez, Asdrúbal Díaz y Gladys de Solórzano,
del FONAIAP, y Oscar Solórzano del MAC, por su colaboración en la
realización
de los trabajos de laboratorio, así como al Br. Pablo Quijada y los Peritos
J.O. Coa, J.L. Ordaz y V. Guerra, quienes de una u otra forma hicieron
posible la realización de este trabajo. RESUMEN En un estudio sobre la marchitez y muerte de cocoteros, cuyos síntomas son similares a los que ocurren en la enfermedad del "Anillo rojo", se como probó que, en el 90 % de los casos, están presentes en los conductos floemáticos de las plantas enfermas, principalmente en los estados iniciales de la enfermedad, protozoarios flagelados de 13,6 - 17,8 µ de largo y 1, 1 2, 1 µ de ancho. Se describe la enfermedad por primera vez en Venezuela, donde se encuentra atacando generalmente plantas adultas en las fincas cocoteras de la Península de Paria, Estado Sucre, en donde se presentan focos de 2 a 6 cocoteros afectados o plantas asiladas, las cuales mueren a los 45 - 60 días luego de haberse observado los primeros síntomas. Del análisis de las malezas e insectos presentes en las fincas cocoteras, se comprobó que las malezas Euphorbia hirta, Euphorbia hypericifolia, Euphorbia sp, Asclepias curassavica y los insectos Oncopeltus semilimbatus, Plapigus patellatus, Chariesterus armatus, Pachybrachius bilobatus y Aphis nerii estaban infestados por protozoarios flagelados. SUMMARY Wilt
or "hart-rot" of coconuts is first reported in Venezuela,
ocurring in Paria Península, State Sucre, affecting commonly adult
plants. The symptoms resemble the ones observed in plants suffering from
"red ring" disease, but are similar to the symptoms described
in Colombia, Surinam and Trinidad. In 90 % of the cases observed,
flagellate protozoa were present in the floematic sieve tubes,
especially in the plants when the disease was at its beginnig. The
diseased plants may be isolated or in a group of 2 - 6 coconuts; and may
die commonly within 45 - 60 days after the first symptoms appeared.
Flagellate protozoa were also found in the following weeds: BIBLIOGRAFIA 1.-
BARROW, R.M., and F. OLIVER. A wilt of coconuts in Trinidad anq its
association with a flagellate protozoan. Journal of the Agricultural
Society of Trinidad and Tobago. 77: 206 - 208. 1977. 2.-
DOLLET, M. Intraphloemic flagellate protozoa (Phytomonas sp.,
Trypanosomatidae) disease of the oil palm coconut in Latin America.
Oleagineux 37 (1): 11-12. 3.-
DOLLET, M., G. LOPEZ, Ph. GENTY and J.L. DZIDO. Current I.R.H.O.
research on coconut and oil palm wilt in South América, associated with
intraphloemic flagellate protozoa (Phytomonas). Oleagineux
34 (3): 108 - 110. 1979. 4.-
DOLLET, M. Y G. LOPEZ. Estudio de la asociación de protozoarios
flagelados con la Marchitez Sorpresiva de la Palma de Aceite en Suramérica.
Oleagineux
35(5):216-217.1978. 5.-
GRIFFITH, R. Wilt Disease of coconuts in the Caribean. Journal of the
Agricultural Society of Trinidad and Tobago. 77: 42 - 50. 1977. 6.-
GRIFFITH, R. The progress on Cedros wilt Disease o, coconuts. Journal of
the Agricultural Society of Trinidad and Tobago. 77: 224 - 239. 1977. 7.-
GRIFFITH, R. Cedros wilt Disease of Coconuts. Journal of the Agricultural
Society of Trinidad and Tobago. 77: 269 - 270. 1977. 8.-
GRIFFITH, R. The transmision of microrganisms associated with Cedros
wilt of coconuts. Journal of the Agricultural Society of Trinidad and
Tobago. 80: 303-310. 1980. 9.-
LAFONT, A. Sur la presence d' un parasite de la classe des flagelles
dans le latex de Euphorbia pilulifera C.R. Soc. Biol. 66: 1011-
1013. 1909. 10.-
LOPEZ, G., Ph GENTY et M. OLLAGNIER. Control
preventivo de la "Marchitez Sorpresiva" del Elaeis guinensi
en
América Latina. Oleagineux.
30 (6): 243-250. 11.-
McCOY, R.E. and G. LOPEZ - MARTINEZ. Phytomonas stabeli associated with
coeonut and oil palm diseases in Colombia. Plant Disease 66: 675-677.
1982. 12.- Mc GHEE, R. B. and Mc GHEE, A.H. Biology and strueture of Phytomonas stabeli sp n. A trypanosomatid located in sieve tubes of coconut and oil palms. Journal Protozool. 26 (3): 348-351. 1979. 13.- PARTHASARATHY, M. V., W.G. VAN SLOBBE and C. SOUDANT. Trypanosomatid flagellate in the phloem of diseased coconut palms. Science. 192: 1346-1348. 1976. 14.-
PARTHASARATHY, M. V., W.G. VAN SLOBBE. Hartrot
of fatal wilt of palms coconuts. I. Cocos nucifera. Principes. Journal
of the Palm Society. Surinam.
22(1):
3-14. 1978. 15.-
STAHEL, G. Zur Kenntnis der Siebröhren-Krankheit (Phloemnekrose) des
Kaffeabaumes in-Surinam. III. Phytopathol. Z. 4 (1): 65 - 82. 1931. 16.- VAN SLOBBE W.G., M. V. PARTHASARATHY and J.A.J. HESEN. Hartrotot fatal wilts of palms .II. Oil Palm (Elaeis guinensis) and other palms Principes. Journal of the Palm Society. Surinam. 22(1) 15-25. 1978. 17.-
WATERS, H. A wilt disease of coconuts from Trinidad associated with Phytomonas
sp a sieve tube - restricted protozoan flagellate. Ann.
Appl. Biol. 90: 293-302. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||